
26.Ca(OH)2 的溶解度较小,20℃时,每100g水仅能溶解0.165g。
⑴20℃时,在烧杯中放入7.4g Ca(OH)2 固体,加水100g,经充分搅拌后,所得饱和溶液体积为100mL。则该溶液中 OH―的物质的量浓度为________mol/L(结果保留三位小数)。
⑵在⑴的烧杯中,需要加入_________mL 0.1mol/L的Na2CO3 溶液,才能使原溶液中的
Ca2+的浓度降至0.01mol/L(假设溶液混合体积可相加)。
⑶已知在20℃时,CaCO3 达到溶解平衡时,有c(Ca2+)·c(CO32-)=0.8×10-8。当溶
液中的c(Ca2+)≤10-5mol/L时,可看作Ca2+沉淀完全。在⑴的溶液中,要使Ca2+沉淀完全,需至少加入______mL 0.1mol/L的Na2CO3 溶液。(结果保留一位小数)
25.材料科学是近年来与化学有关的科学研究的重点,某新型无机非金属材料K由两种非金
属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化等特性。它
是以中学化学中的常见物质为原料来生产的。下图所示为其生产过程,其中虚线框内转化是为探究C的组成而设。已知A、B均为非金属单质,G、F、H均为难溶于水的白色沉淀;图中除D、K(均含A元素)外均为中学化学常见物质。
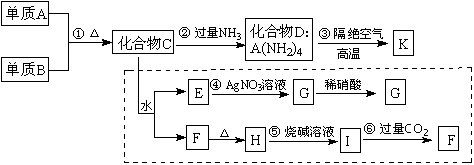
请回答下列问题:
⑴指出K所属的晶体类型 ,K晶体中A原子周围化学键的键角均相等,则其键角值为 。
⑵写出化学式:单质B ,化合物F 。
⑶写出反应③的化学方程式____________________ 。
24.实验室常用准确称量的邻苯二甲酸氢钾(相对分子质量为204)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。据资料,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH应为9.1。
⑴用结构简式表示邻苯二甲酸氢钾与NaOH反应的离子方程式_____________________。
⑵将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂____________(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是_____________________________________________________。
某学生进行了三次实验,实验数据如下表:
|
实验编号 |
邻苯二甲酸氢钾的质量(g) |
待测NaOH溶液的体积(mL) |
|
1 |
0.4080 |
18.20 |
|
2 |
17.10 |
|
|
3 |
16.90 |
⑶滴定中误差较大的是第_____次实验,造成这种误差的可能原因是_______________。
A.碱式滴定管在装液前未用待测NaOH溶液润洗2-3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.在装邻苯二甲酸氢钾前锥形瓶里面有少量水,未烘干
E.滴定开始前,仰视溶液凹液面最低点读数
F.达到滴定终点时,俯视溶液凹液面最低点读数
G.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
H.滴定到终点时,溶液颜色由无色变到了红色
⑷该同学所测得的NaOH溶液的物质的量浓度为___________(结果保留三位小数)。
23.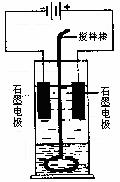 在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层
液体中插入两根石墨电极,圆筒内还放有一根下端弯成环
状的玻璃搅拌棒,可以上下搅动液体,装置如右图。接通
电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极
上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅
动,静置后液体又分成两层,下层液体呈紫红色,上层液
体几乎无色。根据上述实验回答:
⑴ 阳极上的电极反应式为___________________________。
⑵ 阴极上的电极反应式为___________________________。
⑶ 搅拌后两层液体颜色发生变化的原因是_______________________________________。
22.1919年,Langmuir提出等电子原理:原子数相同、电子数也相同的分子,互称为等电子
体。互为等电子体的物质一般结构相似、物理性质相近。
⑴ 根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
____________和____________;____________和____________。
⑵ 此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,
最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元
素组成的物质中,与NO2-互为等电子体的分子有____________、____________。
21. 已知在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)
已知在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H<0,
2SO3(g),△H<0,
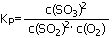
当反应达到平衡后,存在化学平衡常数
⑴ 降低温度,该反应达到平衡后的Kp值_________,
二氧化硫的转化率________,化学反应速率_______
(以上均填“增大”、“减小”或“不变”)。
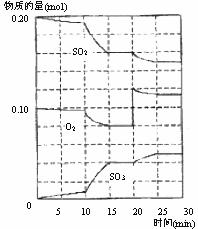
⑵ 600℃时,在一密闭容器中,将二氧化硫和氧气混
合,反应过程中SO2、O2、SO3物质的量变化如右图
所示,反应处于平衡状态的时间是_______________。
⑶ 据图判断,反应进行至10 min时曲线变化的原因
可能是________(填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
20.一定量的乙炔气体燃烧生成二氧化碳气体和液态水,放出Q kJ的热量,生成的二氧化碳
可与19.2g镁恰好完全反应,则乙炔燃烧的热化学反应方程式为____________________。
19.在相同温度下,物质的量浓度相同的下列五种溶液:①Na2CO3,②NaHCO3,③H2CO3,
④NH4HCO3,⑤(NH4)2CO3,按c(CO32-)由大到小的排列顺序是(填写序号) 。
18.已知某溶液中存在OH-、H+、NH4+、Cl-四种离子。经四位同学测定其浓度大小的关系如下,其中不可能的是 ( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
C.c(Cl-)=c(NH4+)>c(H+)=c(OH-) D.c(OH-)>c(H+)>c(Cl-)>c(NH4+)
第Ⅱ卷(非选择题 共46分)
17.分别在pH=1的酸溶液和pH=14的NaOH溶液中加入足量的铝,放出氢气的量前者多,
其原因可能是:①两溶液的体积相同,而酸是多元强酸;②两溶液的体积相同,酸是弱酸;
③酸溶液的体积比NaOH溶液体积大;④酸是强酸,且酸溶液的浓度比NaOH溶液浓度
大;其中正确的为 ( )
A.只有②和③ B. 只有②和④ C.只有①和③ D. 只有①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com