
20.(10分)单质A在适宜条件下有如图所示的一系列转化,其中F是一种红褐色物质。试解答下列各题:
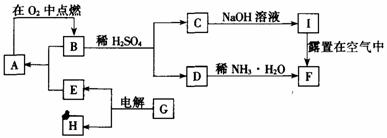
(1)写出下列物质的化学式:A ,B 。
(2)用化学方程式表示下列转化过程
B+H2SO4→C+D:________________ ___________。
I露置在空气中转化为F:_________________________ __。
(3)G可能是_________或_________;每生成1molE同时生成与其对应H的物质的量是________ mol或_________mol。
19.(8分)A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
(2)A是 ,B是 ,C是 ,D是 ,E是 。
(3)A与E反应的离子方程式是 。
18.(14分)实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。


请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是________________________。
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________________________。
(4)装置D的作用是_____________________________________________________。
(5)读取N2的体积时,应注意①__________ __;②________ ___。
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是________________________。
17.(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-==I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-==S4O62-+3I-。
操作:准确称取ag胆矾试样(可能含少量 Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是 。
②实验中加入硫酸,你认为硫酸的作用是 。
③本实验中用碘量瓶而不用普通锥形瓶是因为: 。
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为: 。
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= 。
16.(4分)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)
A、氢气还原氧化铜实验中,先加热氧化铜后通氢气
B、蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C、实验室做钠的实验时,余下的钠屑投入到废液缸中
D、配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E、皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F、制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
15.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)  xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是 ( )
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=4
第Ⅱ卷(非选择题 共88分)
14.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:

下列说法正确的是 ( )
A.上述反应为取代反应 B.维生素C在酸性条件下水解只得到1种产物
C.维生素C不可溶于水,可溶于有机溶剂 D.维生素C的分子式为C6H8O6
13.下列变化或数据与氢键无关的是 ( )
A.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
B.氨分子与水分子形成一水合氨
C.丙酮在己烷和三氟甲烷中易溶解,其中在三氟甲烷中溶解时的热效应较大
D.SbH3的沸点比PH3高
12.对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
11.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com