
1.设NA为阿佛加德罗常数,下列叙述中正确的是
A.46 gNO2与N2O4的混合气体中含有原子数为3NA
B.60g SiO2和12g金刚石中各含有4NA个Si-O键和C-C键
C.标况下22.4L苯完全燃烧生成CO2为6NA
D.7.8gNa2O2与足量CO2反应.转移电子数为0.2NA
25、(12分)
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2、(NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如表(标准状况):
|
实验序号 |
样品的质量 / g |
NaOH溶液的体积 / mL |
氨气的体积 / L |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中有关反应的离子方程式为_____________________,_______________。
(2)由Ⅰ组数据直接推测:标准状态下3.7 g样品进行同样实验时,生成氨气的体积为________L。
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比 。
(4)欲计算该NaOH溶液的物质的量浓度应选择第________组数据,由此求得NaOH溶液的物质的量的浓度为________。
24、(6分)
已知KMnO4、MnO2在酸性条件下将草酸钠(Na2C2O4)氧化,离子反应为:
2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+==Mn2++2CO2↑+2H2O
为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g无水草酸钠固体,再加入足量的稀硫酸(杂质不反应),充分反应后将所得溶液转移到250mL容量瓶中, 用蒸馏水稀释至刻度,摇匀后从中取出25.00mL,再用0.02mol/L KMnO4溶液滴定。当滴入20.00mLKMnO4溶液时恰好完全反应。求该软锰矿中MnO2的质量分数。
23、(10分)
二十一世纪人类健康杀手是心血管疾病。科学家发现某药物X能治疗心血管疾病。醇A可合成X。已知4.60g醇A置于5.00 LO2中充分燃烧后恢复到标准状况下,体积缩小了0.56 L,再将混合气体通过足量的碱石灰,气体体积又缩小了3.36 L 。
(1)试计算:
①、参加反应的O2的体积V(O2)= L,生成的CO2体积V(CO2)= L。
②、该醇的化学式满足下列 通式。(填编号)通过计算确定醇的化学式: 。
A.CX(H2O)Y B.(CXHY)a(H2O)b C.(CXOY)a(H2O)b
(2)烃B和醇A,不论等质量还是等物质的量条件下充分燃烧,生成的水量总是相等。试写出烃B在一定条件下和硝酸反应的化学方程式; 。
(3)A、B的沸点谁高 ,可能原因 。
22、(6分)
实验测得某烃中碳元素的质量分数为91.3%,相对分子质量为92,则该烃的分子式为____________。若该烃为芳香烃,在其分子的“C-C”键或“H-C”键中插入基团“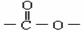 ”可形成六种含苯环的酯,请写出其中四种酯的结构简式:______________、
”可形成六种含苯环的酯,请写出其中四种酯的结构简式:______________、
_________、___________、_________________。
21、(8分)
537℃,1.01×105Pa时,往容器中充入2molSO2
1molO2,此时容器体积为200L,向容器中加入固体催化剂并保持恒温恒压,发生反应:2SO2+O2  2SO3,达到平衡时,平衡气体中SO3体积分数为0.91,试回答下列问题:
2SO3,达到平衡时,平衡气体中SO3体积分数为0.91,试回答下列问题:
(1)工业上生产硫酸采用常压的原因是: 。
(2)保持温度和压强不变,若向容器只充入2molSO3,则平衡时SO2的体积分数为 ,容器的体积为 L。
(3)温度不变,容器的体积保持200L不变(恒容)。充入amolSO2 bmolO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系的压强为1.01×105Pa。若a:b=2:1,则a= mol。
20、(12分)
在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入1 L含3mol H2和1 mol N2混合气体,反应达平衡时有a mol NH3生成,N2的转化率为b %。
(1)若在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x mol H2和y mol N2,反应达平衡时有3a mol NH3生成,N2转化率仍为b %。则x=______;y=_______。
(2)在恒温、恒压和使用催化剂的条件下,设在体积可变的密闭容器中充入x mol H2、y mol N2和z mol NH3,若达平衡时N2转化率仍为b %,则x、y的关系为_______________z的取值范围为_____________。
(3)在恒温(与(1)温度相同)和使用催化剂的条件下,在容积不可变的密闭容器中,充入1 L含3 mol H2和1 mol N2混合气体,反应达平衡时N2的转化率为c %,则b、c的关系为______(用“<”、“=”或“>”表示),理由是 。
19、(6分)
恒压(1.01×105 Pa)下,将2.0 mol
SO2与 a
mol O2 的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2
(g) + O2(g) 2SO3(g),△H<0
2SO3(g),△H<0
(1)T1℃下反应达平衡时,测得容器内n (SO3) = 1.3 mol,n (O2) = 3.0 mol,则a =__________;平衡时SO2 的转化率为__________。
(2)T2℃下反应达平衡时,混合气体的物质的量共为4.8 mol。T1与T2的关系是___________(选填序号)。
① T1>T2 ②T1<T2 ③T1=T2
18、(16分)
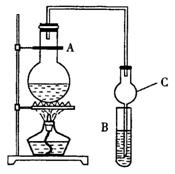 某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知:①无水CaCl2可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知:①无水CaCl2可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:
(1)A中浓硫酸的作用是______;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__ ___。
(2)球型管C的作用是______,若反应前向B中溶液滴加几滴酚酞,呈红色,产生此现象的原因是(用离子方程式表示)__ ___;反应结束后B中的现象 。
(3)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出___________;再加入无水硫酸钠,然后进行蒸馏,收集温度为____________馏分,以得到较纯净的乙酸乙酯。
(4)试分析用氢氧化钠溶液来代替饱和碳酸钠溶液而导致的不利后果
17、(1)(10分)
下列实验操作中,合理的是
A.实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170 ℃
B.实验室制取肥皂时,待植物油、乙醇和氢氧化钠溶液的混合物加热充分反应后,冷却,用纱布滤出固态物质
C.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液
D.验证蔗糖水解产物时,在蔗糖溶液中加入几滴稀硫酸,水浴5 min,加入新制银氨溶液
(2)实验室利用乙醇脱水制备乙烯的步骤如下;
①在蒸馏烧瓶中加人95%的乙醇和浓硫酸的混合物(体积比为l∶3),再加入少量碎瓷片;
②瓶口插上带塞的温度计;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,再用酸性KMnO4溶液检验乙烯的还原性。
据此回答下列问题:
(1)制备乙烯的化学反应方程式为 ;
(2)①中混合乙醇和浓硫酸时应注意 ;
(3)③中使反应温度迅速升高到I7O℃的原因: ;
(4)④中NaOH溶液的作用为 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com