
22.(4分)7.8g过氧化钠投入到93.8g水中,则所得溶液的溶质质量分数为 。
21.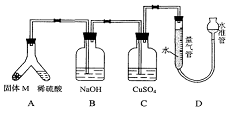 (15分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)。由上述实验事实可知:
(15分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)。由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式)
理由是______________________________________________________________
②M中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是____________________________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥
(6)D装置中在读取气体的体积时,除了要使所得气体的温度冷却到常温,还应注意的问题是: 。
20.甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,甲能发生银镜反应,通过下列转化关系可由甲制取丁:

若丁的相对分子质量总为甲的两倍,乙的相对分质量总大于丙,回答下列问题:
(1)乙的分子结构中一定含有的官能团是 (填名称);
(2)乙、丙的相对分子质量之差为 (填一个数字)的整数倍;
(3)满足上述转化关系的甲、乙、丙、丁中,相对分子质量最小的甲的结构式为
;此时,生成丁的化学方程式为 ;乙与小苏打反应的化学方程式: 。
19.(12分)
I.(1)请将反应物的化学式及配平后的系数填入下列相应的位置中:
FeSO4 + HNO3 → Fe(NO3)3+ Fe2(SO4)3+ N2O↑ +
(2)反应物中发生还原反应的物质__________,被还原的元素是_________。
(3)反应中1 mol还原剂_______(填“得到”或“失去”)___________ mol电子。
II.已知2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-
(1)若向FeI2和FeBr2混合液中通入过量氯气,写出可能发生的离子方程式
。
(2)若向含amolFeI2和bmolFeBr2混合液中通入cmol氯气,当I-、 Fe2+、 Br-完全被氧化时,
c为 mol(用含a,b的式子表示)
18.(6分)氢氧化钾是重要的工业产品。工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
 ①该电解槽的阳极反应式是____________________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因:
①该电解槽的阳极反应式是____________________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因:
_____________________________________________________________________。 ③除去杂质后的氢氧化钾溶液从溶液出口________(填写“A”或“B”)导出。
17.(7分)H、C、N、O、Na、Mg、P、S、Cl、K、Ca是人体中的十一种重要元素。
(1)其中原子半径最大的是 ;
(2)其中单质属于原子晶体的是 ;
(3)其中原子核是由一个中子和一个质子构成的原子可表示为 ;
(4)其中可组成AB型离子化合物,且阴、阳离子电子结构相同的离子化合物的电子式为
;(写出一种即可)
(5)已知4g氢气完全燃烧生成液态水放出571.6kJ热量,试写出表示氢气燃烧热的热化学方程式 。
15.右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S
B.HCl
C.PH3
D.SiH4
 16.将KCl和CrCl3两种固体混合物共熔发生化合反应应制得化合物X。将1.892gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可与过量的KI发生氧化还原反应氧化出2.667gI2,反应的离子方程式是:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,如果取溶有1.892gX的溶液,加入过量的AgNO3,可得4.52gAgCl沉淀,则表示X组成的化学式为:
16.将KCl和CrCl3两种固体混合物共熔发生化合反应应制得化合物X。将1.892gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可与过量的KI发生氧化还原反应氧化出2.667gI2,反应的离子方程式是:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,如果取溶有1.892gX的溶液,加入过量的AgNO3,可得4.52gAgCl沉淀,则表示X组成的化学式为:
A.K3Cr2Cl7 B.K3Cr2Cl5 C.K3Cr2Cl9 D.K2CrCl4
第II卷(非选择题 62分)
14.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
2SO2(g)+O2(g)  2SO3(g); △H=akJ·mol1”。在相同条件下,要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g); △H=akJ·mol1”。在相同条件下,要想得到2akJ热量,加入各物质的物质的量可能是
A.4molSO2和2molO2 B.6molSO2和4molO2
C.4molSO2和4molO2 D.4molS02,2molO2和2molSO3
13.在FeCl3和AlCl3的混合溶液中,先加入过量的NaI溶液,再加入足量的Na2S溶液,则
所得到的沉淀是
A.Al2S3和I2 B.Fe2S3和I2
C.FeS、S和Al (OH)3 D.Fe (OH)2和Al (OH)3
12.已知充分燃烧ag乙炔气体时生成0.5mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4bkJ/mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);△H=-2bkJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2bkJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=bkJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com