
13.下列有关物质性质的描述不正确的是
A.SO2气体通入溴水中使溴水褪色,属于氧化还原反应
B.胶体能发生电泳现象是由于胶体粒子带电
C.BrCl与Br2、Cl2的化学性质相似,则BrCl+H2O=HBr+HClO
D.在Al(OH)3胶体中逐渐加入稀的Ba(OH)2溶液至过量,先有沉淀后沉淀溶解
12.下列叙述不正确的是
A.用酒精清洗沾到皮肤上的苯酚
B.用冷凝的方法从氨气、氮气和氢气混合气中分离出氨
C.用盐析的方法分离油脂皂化反应的产物
D.用氨水清洗试管壁附着的银镜
11.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
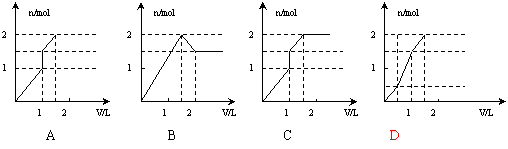
10.已知:①向KmnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
9.某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为
n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
8.化学用语是学习化学的重要工具,下面用来表示物质变化的化学用语中,正确的是
A.氢气燃烧的热化学方程式:2H2(g)+ O2(g)=2H2O(l); △H= +570kJ·mol-1
B.甲烷碱性燃料电池的负极反应:CH4+10OH--8e-= CO32-+7H2O
C.饱和FeCl3溶液滴入沸水中的反应:FeCl3+3H2O = Fe(OH)3↓+3HCl↑
D.铝片溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
7.设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A.如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n
B.15.6g Na2O2与过量CO2反应时,转移的电子数为0.2 NA
C.在一定条件下,6.4g SO2与足量O2反应生成SO3的分子数为0.1NA
D.T℃时,1 L pH=6纯水中,含10-6NA个OH-
6.2004年,美国科学家通过"勇气"号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS)的物质。已知硫化羰分子中所有原子最外层均满足8电子结构。下列说法正确的是
A.硫化羰是酸性氧化物 B.硫化羰结构式为S=C=O
C.硫化羰属于非极性分子 D.硫化羰为分子晶体,沸点比CO2低
21、(10分)
向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?
20、(10分)
化合物KxFe(C2O4)y· zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.49lg两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3 mol·L-1 H2SO4和适量的蒸馏水,加热至75℃,趁热加入0.0500mol·L-1KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0 mL0.0500mol·L-1KMnO4溶液完全反应。通过计算,分别求:
(1)0.49lg样品中结晶水的物质的量。
(2)化合物中草酸根的质量分数。
(3)化合物的化学式。
己知:2 KMnO4 + 5 H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+ 8H2O
MnO4-+5Fe2++8H+=Mn2+ + 5Fe3+ + 4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com