
6.下列实验能达到预期目的的是
.. ①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
.. ②将Cl2的制备和性质实验联合进行以减少实验中的空气污染
.. ③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
.. ④用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子
.. ⑤用溴水检验汽油中是否含有不饱和脂肪烃
A.①②③ B.①③④ C.②③⑤ D.②④⑤
5.下列说法正确的是
A.用乙醇或CCl4可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1∶1
D.H2S和SiF4分子中各原子最外层都满足8电子结构
4.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.H2O2 B.IO3- C.MnO4- D.HNO3
3.根据相关化学原理,下列判断正确的是
A.若X是原子晶体,Y是分子晶体,则熔点:X < Y
B.若A2 + 2D- → 2A- + D2,则氧化性:D2 > A2
C.若R2-和M+的电子层结构相同,则原子序数:R > M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA < NaB
2.同主族两种元素原子的核外电子数的差值不可能为
A.8 B.14 C.26 D.44
1.闪电时空气中有臭氧生成。下列说法中正确的是
A.O3和O2互为同位素 B.O2比O3稳定
C.等体积O3和O2含有相同质子数 D.O3与O2的相互转化是物理变化
25、 将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g);ΔH>0,并达平衡。
2HI(g);ΔH>0,并达平衡。
HI的体积分数w(HI)随时间变化如图曲线b所示:
(1)达平衡时,I2(g)的物质的量浓度为___________。
(2)若改变反应条件,
在甲条件下,w(HI)的变化如图曲线a所示,
在乙条件下,w(HI)的变化如图曲线c所示。
则甲条件可能是__________;乙条件可能是___________。(填入下列序号)
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是________ ___。
24、(8分)根据下表数据,请回答下列问题:
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
⑴ 比较下列两组物质的熔点高低 (填>或<= SiC______ Si; SiCl4 ______ SiO2
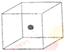 ⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g)  Si(s) + 4HCl(g)
该反应的反应热△H = ______ KJ/mol
Si(s) + 4HCl(g)
该反应的反应热△H = ______ KJ/mol
23、(12分)同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。请回答下列问题:
(1)根据以上条件判断出符合题意的元素,请写出相应的元素名称:
A________、B_______、C______、D_______、E_______、F______。
⑵画出B的原子结构示意图:________ ___。(3)写出C单质与A的最高价氧化物的水化物的水溶液反应的离子方程式:
(4)若1 mol F单质与C的单质恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物的水化物反应,消耗_________ mol A的最高价氧化物的水化物。
22、 (15分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等。
(15分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等。
图5-45是实验室制取少量无水氯化铝装置的一部分,在方框中安装某些仪器,便是该装置的另一部分,从A口通入某种气体,即可制取无水氯化铝。现提供的试剂除装置中已有的铝粉和碱石灰外,还有NaCl固体、MnO2、浓H2SO4和水,而提供的安装方框中装置的仪器不限,用上述方法制取无水氯化铝,请回答下列问题:
(1)利用上述条件,可制取的气体有(填化学式) ____ __;
(2)若要安全、顺利地制取无水氯化铝,通入A口的气体应是 ______;
(3)用中学化学实验室常用的方法制取通入A口的气体的反应方程式是___ ___
(4)用(3)的方法制得的气体中可能还含有的气体有 ___ ___,通入A口前是否有必要除去,不必除去或必须除去的原因是____ __;
(5)按(3)的方法安装方框图中的装置,所需要的玻璃仪器(同一种仪器,数量在2件或2件以上的要写明件数)有_____ _;
(6)装置图中甲、乙两支干燥管中需要填充碱石灰的是(填甲或乙或甲、乙)______,甲的作用是____ __,乙的作用是___ ___。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com