
26.(8分)
.. 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、
Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
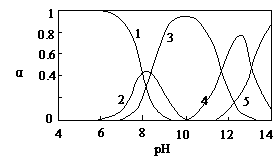
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2、,4表示Pb(OH)3-,5表示Pb(OH)42-]
(1)
Pb(NO3)2溶液中,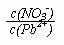 2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,
2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,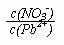 增大,可能的原因是
。
增大,可能的原因是
。
(2)往Pb(NO3)2溶液中滴稀NaOH溶液,pH = 8时溶液中存在的阳离子(Na+除外)有
,pH = 9时,主要反应的离子方程式为 。 (3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
|
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
|
|
处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
|
|
处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
|
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s) + Pb2+ E2Pb(s) + 2H+
E2Pb(s) + 2H+
则脱铅的最合适pH范围为 (填代号)。
A.4-5 B.6-7 C.9-10 D.11-12
25.(8分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 ,
K值大小与温度的关系是:温度升高,K值 。
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g) + H2O(g) 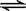 CO2(g) + H2 (g) △H1 <0
CO2(g) + H2 (g) △H1 <0
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)= mol/(L•min)
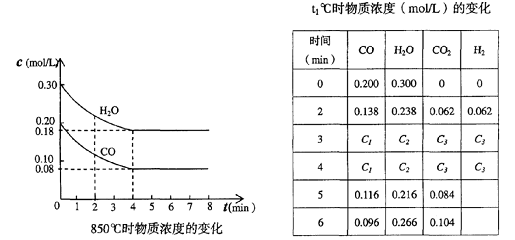
(3) t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于 状态;
C1数值 0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min-6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
24.(13分)
... 往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在
某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该
Mg(OH)2的生产工艺如下:
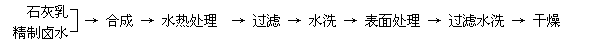
.. (1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx•mH2O],
反应的化学方程式为 。
.. (2)合成反应后,继续在393K-523K下水热处理8h,发生反应:
[Mg(OH)2-xClx•mH2O]== (1-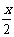 ) Mg(OH)2 +
) Mg(OH)2 +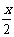 MgCl2 + mH2O
MgCl2 + mH2O
水热处理后,过滤、水洗。水洗的目的是 。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流
程中与此有关的步骤是 。
(4)已知热化学方程式:
Mg(OH)2(s) == MgO(s) + H2O(g) △H1 = +81.5 kJ·mol-1
Al(OH)3(s) ==
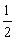 Al2O3(s) +
Al2O3(s) + 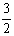 H2O(g) △H 2 = +87.7 kJ·mol-1
H2O(g) △H 2 = +87.7 kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
(5)常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,
主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是
(填代号),理由是 。
23.(6分)
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上的气态化合物,则
(1) Y是 、Z是 (填元素名称)。
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是 。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是(离子符号) 和 。
(4) X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是 。
22.(12分)
.. 某研究小组进行与NH3有关的系列实验。
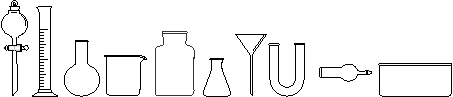
(1) 从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、
胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为 。
(3)为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如第6页右上图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略);HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好。
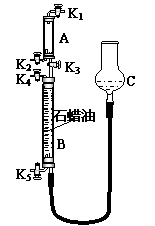 ①在A管中充满与大气压强相等的干燥HCl气体。操作是
①在A管中充满与大气压强相等的干燥HCl气体。操作是
。
控制活塞K4、K5,调节C,使B管充满与A管同压的干
燥NH3。
②缓缓开启K3,A管中的现象是 。
要达到实验目的,当反应完成并恢复到室温时,B管中预
期的现象是 ;
若观察不到预期现象,主要原因是 。
21.(13分)
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅。
①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥HCl气体反应制得SiHCl3: Si + 3HCl SiHCl3 + H2
③ SiHCl3与过量H2在1000-1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量
SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
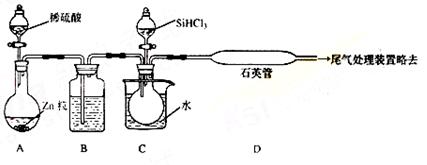
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是:
。
②装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
20.某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g) + Y(g) 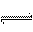 Z(g) + W(s) △H>0下列叙述正确的是
Z(g) + W(s) △H>0下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应到达平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的△H增大
第二卷 非选择题(共80分)
19.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g) + 3H2(g)
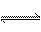 2NH3(g) ,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如
2NH3(g) ,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如
下图所示。下列叙述正确的是
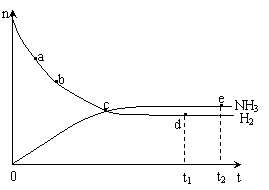
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
18.下列实验中,溶液颜色有明显变化的是
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO3溶液中
D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
17.SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最
外层电子均满足8电子结构。下列说法正确的是
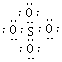
A. SO42-的电子式为 B.S2O82-中没有非极性键
C.S2O82-比SO42- 稳定 D.S2O82-有强氧化性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com