
8、在100 mL某混合溶液中,C(HNO3)=0.4mol/L,C(H2SO4)=0.1mol/L。向其中加入1.92g铜粉,微热,充分反应后溶液中C(Cu2+)为(假设溶液体积不变)
A、0.15 mol/L B、0.3 mol/L C、0.225 mol/L D、无法计算
7、同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
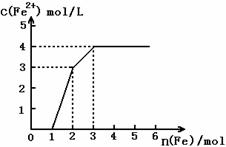
6.已知:2Fe3+ + Cu → Cu2+ +2Fe2+ 。现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe与稀硝酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+ 浓度和加入铁粉的物质的量之间关系如下图所示。则稀溶液中Fe(NO3)3、
Cu(NO3)2、HNO3物质的量浓度之比为
A.1︰1︰1 B.1︰3︰1 C.3︰3︰8 D.1︰1︰4
5. t℃时,甲、乙两个烧杯中各盛有100g(密度为1.10g/cm3)相同浓度的KCl溶液。现将甲烧杯中的溶液蒸发掉35.0g H2O,恢复到t℃时,析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g。下列说法正确的是
A.原溶液的质量分数为20% B.t℃时,KCl的溶解度为50.0g
C.原溶液的物质的量浓度为3.0mol/L
 D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
4、下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀溶液共热 B、1molCu与含4molHNO3的浓硝酸
C、1molCu与含2molH2SO4的浓硫酸共热 D、1molMnO2与含4molHCl的浓盐酸共热
3、下列叙述中正确的是
A、CO2分子内含有极性键,所以CO2分子是极性分子
B、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
C、气态氢化物的稳定性:NH3>PH3>AsH3
D、某非金属元素从游离态变成化合态时,该元素一定被还原
2.最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4沸点比P4(白磷)高
C.N4与N2互为同素异形体 D.1mol N4气体转变为N2将吸收882kJ热量
1、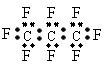 最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A、分子中三个碳原子可能处于同一直线上 B、全氟冰烷的电子式为:
C、相同压强下,沸点:C3F8<C3H8
D、全氟冰烷分子中既有极性键又有非极性键
28.(14分)
钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[ Co(NH3)xCly ]Clz的
组成,进行如下实验:
①称取样品0.5010 g,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。
产生的氨用50.00 mL 0.5000 mol•L-1的盐酸完全吸收并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL, 用0.1000 mol•L-1 NaOH滴定,消耗NaOH溶液30.00 mL。
... ②向A中加入过量KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com+ + I- → Co2+ + I2 (未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000 mol•L-1Na2S2O3溶液20.00 mL。反应方程式为:I2 + 2Na2S2O3 == 2NaI + Na2S4O6
③另称取该物质样品0.2505 g溶于水,以0.1000 mol•L-1 AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应式为:
[ Co(NH3)xCly ]Clz + zAgNO3 == [ Co(NH3)xCly ](NO3)z + zAgCl↓
通过计算求:
(1) [ Co(NH3)xCly ]Clz中氮元素的质量分数。
(2)该钴化合物的化学式。
27.(6分)
合成氨工业生产中所用的α―Fe催化剂的主要成分是FeO、Fe2O3 。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为 。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为 (用小数表示,保留2位小数)。
 (3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3 + C 4FeO + CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中
加入炭粉的质量为 g 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com