
12.常温下,下列各溶液中,微粒的物质的量浓度关系正确的是
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
11.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
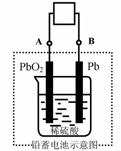 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由A到B
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
10.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。 ②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。 ③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。 ④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定C1-离子是否存在 D.不能确定HCO3-离子是否存在
9.下列各选项所述的两个量,前者一定大于后者的是
①F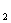 和Br
和Br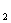 的沸点 ②纯水在25℃和80℃时的pH
的沸点 ②纯水在25℃和80℃时的pH
③同温下分别在100 g水中最多能溶解的无水CuSO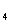 和CuSO
和CuSO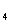 · 5H
· 5H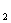 O的质量
O的质量
④25℃时,等体积且pH都等于5的盐酸和AlCl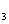 溶液中,已电离的水分子数
溶液中,已电离的水分子数
⑤在NH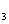 +NO-→ N
+NO-→ N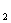 +H
+H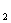 O(未配平)反应中,被氧化和被还原的N原子数
O(未配平)反应中,被氧化和被还原的N原子数
⑥耐火材料MgO和CaO的熔点 ⑦H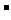 和H
和H 的离子半径
的离子半径
A.①②④ B.②③⑤ C.②⑥⑦ D.⑤⑥⑦
8.2005年10月12日我国成功发射了第二艘载人航天飞船--“神州六号”,实现了双人多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g); △H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g); △H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l); △H = – 601.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l); △H = – 1135.7kJ/mol
7.用NA表示阿伏加德罗常数,下列说法一定正确的是
A.足量钠与32g氧气完全反应转移的电子数为2NA
B.含1mol碳原子的碳单质中,C-C共价键数为1.5NA
C.在标准状况下,11.2LNO与N2混合气中含原子数为NA
D.pH=1的盐酸、硫酸混合溶液中,所含H+离子数为0.1NA
6.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使之成为第二个地球的计划。有关全氟丙烷的说法正确的是
A.分子中三个碳原子可能处于同一直线上
B.全氟丙烷在固态时晶体类型为原子晶体
C.相同压强的条件下,沸点:C3F8<C3H8
D.全氟丙烷分子中既有极性键又有非极性键
5.已知下列三组实验:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共发生了两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
4.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.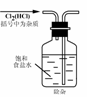 B.
B.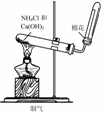
C.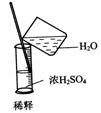 D.
D.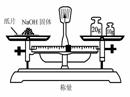
3.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学、
生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,
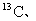
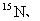
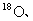
 等常用作环境分析指示物。下列说法正确的是
等常用作环境分析指示物。下列说法正确的是
A. 原子核内中子数为16
原子核内中子数为16
B.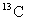 和
和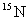 原子核内的质子数相差2
原子核内的质子数相差2
C.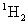
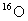 在相同条件下比
在相同条件下比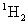
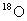 更易蒸发
更易蒸发
D.相同条件下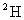 +的酸性比
+的酸性比 +的酸性更强
+的酸性更强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com