
7.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体 B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1:2
D.N4的摩尔质量是56g
6.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象
A.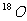
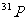
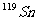
B.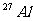

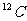
C.元素周期表中VA族所有元素的原子
D.元素周期表中第1周期所有元素的原子
5.从矿物学资料查得,一定 条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O====7Cu2S+5FeSO4+12H2SO4.下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
4.下列指定微粒的个数比为2∶1的是
A.Be2+离子中的质子和电子 B.21H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子 D.BaO2(过氧化钡)固体中
3. 下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+ === Ca2+ + 2H2O
B.钠与水的反应Na + 2H2O === Na+ + 2OH -+ H2↑
C.铜片插入硝酸银溶液中Cu + Ag+ === Cu2+ + Ag
D.大理石溶于醋酸的反应CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O
2. 下列离子中,所带电荷数与该离子的核外电子层数相等的是
A.Al3+ B.Mg2+ C.Be2+ D.H+
1. 能与人体血液中血红蛋白结合的一种有毒气体是
A.氯气 B.氮气 C.一氧化碳 D.甲烷
25.(10分)铝是国民经济发展的重要材料, 铝在地壳中含量约占8%,目前我国铝消费超过430万吨,在众多的金属中仅次于钢铁。
(1)工业上制取铝的流程图如下:
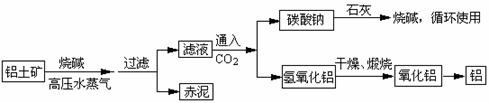
在制取氧化铝中,分析铝土矿和赤泥所得数据如下:
|
|
Al2O3 |
Fe2O3 |
NaOH |
其它杂质 |
|
铝土矿 |
55% |
16% |
0 |
/ |
|
赤泥 |
15% |
48% |
8% |
/ |
设其它杂质不参加反应,则每生产1 t 纯净氧化铝,需铝土矿的质量为 吨, 投入的烧碱固体为 吨。
(2)国家行业标准中铸造铝合金的各成分的质量分数为:Si-4.5%-5.5%,Cu-1.0%-1.5%,Mg-0.4%-0.6%,其余为Al。现对某铸造铝合金产品的质量进行如下实验检测:①称取18.0g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
②待两份反应物都充分反应之后,称得滤渣质量相差0.512g,收集得到的两份气体的体积相差851.2mL(标准状况下)。
请通过计算判断该品牌的铸造铝合金是否为合格产品。
24.(8分)某化合物中含X、 Y 、Z三种元素,其中有两种金属元素,X为其中一种,其原子个数组成比是X:Y:Z=1:2:4。将1.98g该化合物溶于水,滴加适量的稀硫酸后,再加入1.12g还原铁粉,恰好完全反应,铁元素全部以Fe2+存在。向反应后的溶液中加入适量的KOH溶液,使Fe2+刚好沉淀完全,过滤,将沉淀充分加热后,得到红色Fe2O3粉未2.4g。将滤液在一定条件下蒸干,只能得到一种纯净且不含有结晶水的含氧酸盐(不为复盐)6.96g。试通过计算推断该化合物的化学式。
23.(10分) 不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
电负性值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围 。
(2)请归纳元素的电负性和金属、非金属的关系是 ;
(3)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(4)从电负性角度,判断AlCl3是离子化合物,还是共价化合物的方法是:(写出判断的方法和结论) ;请设计一个实验方案证明上述所得到的结论: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com