
28.将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2和N2O4的互变)。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入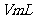
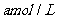 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
mol/L。
全部转化成沉淀,则原硝酸溶液的浓度为
mol/L。
(3)欲使铜与硝酸反应生成的气体在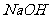 溶液中全部转化为
溶液中全部转化为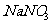 ,至少需要30%的双氧水
g。
,至少需要30%的双氧水
g。
27.X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气), Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
。
26.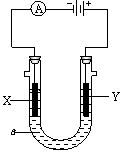 电解原理在化学工业中有广泛应用。右图表示一个电解池,
电解原理在化学工业中有广泛应用。右图表示一个电解池,
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
25.恒温恒压下,在容积可变的器皿中,反应2NO2(g)====N2O4(g).达到平衡后,再向容器内通入一定量的2NO2(g),重新达到平衡后,与第一次平衡时相比,2NO2的体积分数:
A、不变 B、增大 C、 减小 D、无法判断
24.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是A.NH4Cl NH3↑+HCl↑
B.NH3+CO2+H2O NH4HCO3
C.2NaOH+Cl2 NaCl+NaClO+H2O
D.2Na2O2+2CO2 2Na2CO3+O2
22.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
23等体积的PH=12的碱甲溶液和PH=11的碱乙溶液,分别用等体积的盐酸中和时,消耗盐酸的体积为2V(甲)=V(乙)。下列判断合理的是:
A、乙一定是弱碱 B、甲一定是强碱 C、乙一定是二元碱 D、甲一定是一元碱
21.某溶液既能溶解Al(OH)3,又能溶液解H2SiO3,在该溶液中可以大量共存的离子组是
A.K+、Na+、HCO3-、NO3- B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3-、、Na+
20. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn-2e-+2OH-====Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-====FeO42-+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
19.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐降低
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
18.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3-O-CH3)高,主要原因是乙醇分子间能形成氢键
C.反应AgCl+NaBr====AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com