
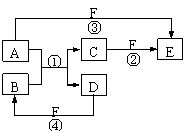
32. (12分)A、B、C、D、E、F六种物质
的相互转化关系如下图所示:
注:所有反应条件及部分产物未标出,
其中反应①是置换反应。
⑴若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是__________ _,反应④发生的条件是 。
⑵若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行的,则反应②的离子方程式是_____;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式__________。
⑶若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生, A、D相遇有白烟生成, 则C的电子式是__ __,反应③的化学方程式是 ___。
⑷若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是 ____ 。
30.(4分)已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol·L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性,
(1)H5IO6是 (填“强电解质”或“弱电解质”)
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂是
(填化学式),反应的离子方程式为
31,(共14分).(1) (2分)录像用的高性能磁粉,主要材料之一是由三种元
素组成的化学式为CoxFe(3-x)O(3+x)的化合物。已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价。则x值为______,钴的化合价________。
(2)(2分)温度相同、浓度均为0.2mol/L的a.(NH4)2SO4、b.NaNO3、c.NH4HSO4、d.NH4NO3 e.苯酚钠、f.CH3COONa溶液pH值由小到大的顺序是(填序号)
(3)(2分)写出Na2S的水解离子方程式
(4)(1分)常温下由水电离出的c(H+)=10-3.5mol/L,则此溶液的pH值为
(5).(2分)某温度下测得0.01mol/L的NaOH溶液的pH值为11,在此温度下,将PH=a的NaOH溶液V1L与pH=b的H2SO4溶液V2L混合,若所得的溶液的pH=10,且a=12,b=2,则V1:V2=
(6).(5分)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解, 同时还产生的现象有:① ②
用离子方程式表示产生上述现象的原因是
在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是
A.磷 B.硫 C.镁 D.铜
 五(本题包括3小题,共32分)
五(本题包括3小题,共32分)
29.(5分)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 。若先往FeCl3溶液中加入一些NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色.对这一现象有三种解释:
(1)F-能还原Fe3+,使之转化为Fe2+,(2)F-能与Fe3+结合成难电离的物质,
(3)F-能与SCN-反应,消耗了加入溶液中的SCN-。
对以上三种解释,你认为错误的是 ,理由是
28.(9分) 工业制纯碱时,第一步是通过饱和食盐水、氨气和二氧化碳反应,获得碳酸氢钠结晶体。它的化学反应原理可以用下面方程式表示:
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。请设计一个简单的实验装置模拟实现这一过程,并获得NaHCO3结晶。可供选择的实验用品有:
6mol/L盐酸、6mol/L硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水、冰,以及中学化学常用仪器。
(1)画出实验装置图并在图中容器旁分别注明A,B,C,…符号。
说明:(1)本题装置示意图中的仪器可以用下面的方式表示:


 敞口玻璃容器
敞口玻璃容器 有塞玻璃容器
有塞玻璃容器 玻璃漏斗
玻璃漏斗
 分液漏斗
分液漏斗 玻璃导管
玻璃导管
(但应标示出在液面上或液面下)
(2)铁架台、石棉网、酒精灯、玻璃导管之间的连接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。)
(2)请在图上标出各玻璃容器中盛放物质的化学式或名称。
(3)利用本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶体,而不是碳酸氢铵或食盐结晶体。
2. 。
实验原理:(提示:结合题中信息和实验目的进行分析) 。
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写) 。
实验步骤:(用准确、简洁的语言填写下表)
|
实 验 步 骤 |
实验现象 |
化 学 方 程 式 或 实 验 结 论 |
|
|
固体在水中 溶 解 |
|
|
|
溶液出现棕 黄 色 |
|
|
|
|
“淮”牌精制盐中含有碘元素。 |
问题讨论:广东有100多km的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是广东人的主要副食品,广东人的食用盐中需要加碘吗?说明你的理由。
27、(16分)I、下表是广东顺德某超市出售的“淮牌”加碘精制盐的有关说明:
|
产 品 标 准 号 |
Q/320000JYJ03-2004 |
|
许 可 证 号 |
食盐批字第100070号 |
|
配 料 表 |
精制盐、碘酸钾 |
|
含 碘 量 |
35±15mg/kg |
|
卫生许可证号 |
东卫食字(2005)第00015号 |
|
分 装 日 期 |
见封口 |
|
储 藏 方 法 |
通风、防潮 |
|
食 用 方 法 |
根据烹调所需适量加入 |
|
食品标签认可号 |
苏食签(2002)007号 |
II、下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源。目前世界上碘主要来自智利硝石,其中含碘0.02%-1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等粘膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2 …………①
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 …………②
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应。
根据以上信息,回答下列问题:
⑴反应①的离子方程式: ; I2在反应①中是 (填“氧化”或“还原”,下同)产物,在反应②中是 产物;
⑵请你设计实验探究上述 “淮牌”精制盐中是否真的含有碘元素。
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
26.(1)(2分)下面列出了一定温度下每立方厘米(cm3)活性炭所能吸附的常见气体的体积,分析下面的数字与气体的组成、性质等的关系,根据此表,你认为下列结论正确的是
|
|
H2 |
CO2 |
O2 |
N2 |
Cl2 |
|
气体的沸点/℃ |
-252 |
-78 |
-183 |
-196 |
-34 |
|
被吸附体积/mL |
4.5 |
97 |
35 |
11 |
494 |
A.分子中所含原子数目多时,气体易被吸附
B.沸点越高的气体,越易被吸附
C.气体的相对分子质量越大,越易被吸附
D.气体是化合物时,易被吸附
25. 经测定某溶液中离子只有Na+、Ac-、H+、OH-四种,且离子浓度大小的排列顺序为: c(Ac-)>c(Na+)>c(H+)>c(OH-)。其可能的情形是
A.该溶液由pH=3的HAc与pH=11的NaOH溶液等体积混合而成
B.0.2mol/L的HAc溶液与0.1mol/L的NaOH溶液等体积混合
C.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(Ac-)>c(Na+)>c(OH-)>c(H+)
D.该溶液由0.1mol/L的HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成
24. 将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是
A. 若V1>V2,则说明HA的酸性比HB的酸性强
B. 若V1>V2,则说明HA的酸性比HB的酸性弱
C. 因为两种酸溶液的pH相等,故V1一定等于V2
D. 若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
23. 要求设计实验证明,某种盐的水解是吸热的,下列回答正确的是
A. 将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的
C. 在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D. 在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com