
19.(10分)(1)使用常用仪器,运用化学原理进行巧妙的设计,就可以用同一个简单的装置实现多种用途。
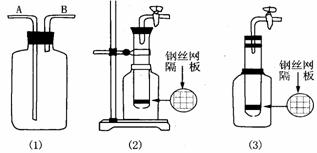
Ⅰ、利用上图中(1)装置,用两种不同的方法分别收集NO,试简述操作方法:
; 。
 Ⅱ、甲同学把试管底部钻出一小洞,并和广口瓶组成图中(2)装置,通过开、关导管上的阀门可以控制试管内的反应随时发生或随时停止。如果该装置中的隔板是用铜丝制成,则该装置可以制取的常见气体有
(填二种)。
Ⅱ、甲同学把试管底部钻出一小洞,并和广口瓶组成图中(2)装置,通过开、关导管上的阀门可以控制试管内的反应随时发生或随时停止。如果该装置中的隔板是用铜丝制成,则该装置可以制取的常见气体有
(填二种)。
Ⅲ、乙同学认为,可把(2)装置做如下图(3)的改动,用橡皮塞替代铁架台来固定试管。请判断乙同学的做法是否可行? .
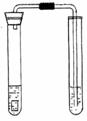
(2)拟用如右图所示装置进行硝酸与铜反应的实验。
为了防止污染,在右边的试管中盛放足量的NaOH溶液。
 若实验中使用的是质量分数为63%的硝酸和小铜片,
若实验中使用的是质量分数为63%的硝酸和小铜片,
操作中怎样加入硝酸和铜片才能避免铜与硝酸刚一接触
时生成的气体外逸到空气中:______________________
18.NH3和O2的混合气100mL通过红热的铂网,充分反应后的混合气再通过足量水最终收集到10mL残留气体,则原混合气中O2体积不可能是(气体体积在相同条件下测定)
A.12.5mL B.21.5mL C.64.2mL D.70.0mL
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
16.若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A.2ω1=ω2 B.2ω2=ω1 C.ω2>2ω1 D.ω1<ω2<2ω1
15.在加热的条件下,氟气与等物质的量的烧碱反应,生成氟化钠、水和另一种气体物质,该气体物质的化学式是
A.H2 B.HF C.O2 D.OF2
14.下列反应中,调节反应物用量或浓度将改变生成物的是
A.硫化氢通人FeCl3溶液中 B.铁在硫蒸气中燃烧
C.CO2通入漂白粉溶液中 D.硫酸与锌粉反应
13.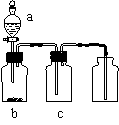 在下列反应中,浓硫酸既表现氧化性,又表现酸性的是
在下列反应中,浓硫酸既表现氧化性,又表现酸性的是
A.FeO+H2SO4(浓) B.Cu+H2SO4(浓)
C.C+H2SO4 (浓) D.CuO+H2SO4 (浓)
11.下列结论正确的是
①微粒半径:S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se
A.②④⑥ B. ①③④ C. 只有① D. 只有⑥
12用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
|
|
气体 |
a |
b |
c |
|
A |
NO2 |
浓硝酸 |
铜片 |
NaOH溶液 |
|
B |
SO2 |
浓硫酸 |
Cu |
酸性KMnO4溶液 |
|
C |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
|
D |
CO2 |
稀盐酸 |
CaCO3粉末 |
浓硫酸 |
10.NA表示阿伏加德罗常数,以下说法正确的是
A.31g白磷含有P-P键的总数为6NA;
B.1.6gNH2-离子含有电子总数为NA;
C.1L 1mol·L-1FeCl3溶液中含有Fe3+的数目为NA;
D.标准状况,密闭容器中22.4L NO 和22.4L O2的混合气体所含分子数为1.5NA 。
9.向1L 0.5mol/L的H2SO4溶液中加入10.1gKNO3和12.8gCu充分反应后产生的气体在标准状况下的体积为
A.2.24L B.3.36L C.4.48L D.5.60L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com