
3.下列有关碱金属铷的叙述中,正确的是
A.灼烧氧化铷时,火焰有特殊颜色 B.硝酸铷是离子化合物,不易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是弱碱
2.在医学、日常生活中常见的溶液:①福尔马林 ②医用消毒酒精 ③生理盐水 ④食醋,这些溶液中的溶质质量分数由大到小顺序为
A.①②③④ B.①②④③ C.②④①③ D.②①④③
1.下列说法正确的是
A.二氧化硫和氯气都易液化,因为它们的沸点很低
B.大气中二氧化硫的主要来源是化石燃料的燃烧
C.正常雨水的pH小于5.6 D.二氧化硫能使紫色的石蕊试液变红又褪色
26.(10分)向NaBr与NaI的混合溶液中通入适量Cl2、反应完全后将溶液蒸干并小心灼烧至恒重,得固体W。
(1)W的可能组成为① ;② ;③ ;④ 。(填化学式,可以多填或少填)
(2)现将一NaBr与NaI的混合固体l 0.0g溶于适量水中,通入448mL Cl2(标准状况)充分反应后,按上述操作得到W的质量为7.28g.求原混合物中Na I的质量分数?
25.(10分)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体多少升?(设反应中HNO3被还原成NO)
24.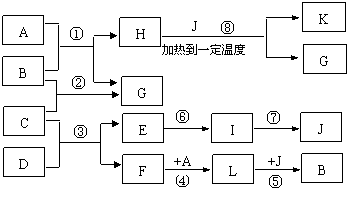 (9分)已知A是常见气体,K是石油化学工业的重要的基础原料,可做植物生长调节剂,G是无色液体,B、C为气体单质,L为金属固体,D、E、I、J四种物质中含同一种元素。图中一些反应条件和产物已省去。
(9分)已知A是常见气体,K是石油化学工业的重要的基础原料,可做植物生长调节剂,G是无色液体,B、C为气体单质,L为金属固体,D、E、I、J四种物质中含同一种元素。图中一些反应条件和产物已省去。
(1)工业上反应③在 _______________中进行,反应⑥在 _______________中进行,反应⑦在_______________中进行(均填工业设备名称)。
(2)反应①的化学方程式是______________________________________________。
反应③的化学方程式是______________________________________________。
反应⑧的化学方程式是______________________________________________。
23.(8分)麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,此反应的化学方程式为 。有关理论认为N2O与CO2分子具有相似的结构(包括电子式),则N2O为 分子(极性或非极性)电子式为 。
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒光气(COCl2):2CHCl3+O2 2HCl+2COCl2,为了防止事故,使用前可用于检验氯仿是否变质的试剂是 。
A.淀粉一碘化钾溶液 B.NaOH溶液
C.酚酞溶液 D.硝酸酸化的AgNO3溶液
22.(9分)把H2S通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸可被空气中的O2氧化为I2。I2在水溶液中易与红磷反应生成PI3,并水解生成HI和H3PO3(亚磷酸)
(1)写出氢碘酸氧化变质的离子方程式: ;
(2) (填“能”或“不能”)用浓硫酸与固体NaI共热制HI,原因是: .
(3)在配制的氢碘酸溶液中,可加入少量的红磷。当该溶液置于空气中时,只要溶液的体积不变,则所配制HI溶液的物质的量浓度不会变化。其原因是(用化学方程式表示): 。
21.(12分)我国许多煤矿的硫含量比较高,将其直接燃烧产物排人大气既会造成“大气污染”,还会形成“酸雨”造成“水污染”。SO2在雨水中的存在形式为(写化学式) 。
某校课外活动小组的同学收集几瓶雨水,进行以下实验:
(1)甲同学用试管取少量雨水滴入几滴品红溶液,振荡后品红不褪色,由此他的结论是该雨水不含SO2。他的结论 (填“正确”或“错误”);因为 。
(2)乙同学也用试管取少量雨水,滴入足量BaCl2溶液,发现有少量白色浑浊,写出该实验的化学反应方程式:__________________________________________________,乙同学应该得出的结论是___________________________________________________。
(3)丙同学将乙同学所作实验浑浊溶液过滤,先滴入几滴稀HNO3,再加入BaCl2溶液,又发现白色浑浊。滴人稀HNO3的化学反应方程式为: ;丙同学应该得出的结论是__________________________________________________。
20.(10分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙和稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 ;
装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 ;一段时间后,C中白色沉淀溶解,其原因是 。
(3)装置D的作用是 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com