
8.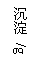
 把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如下图,则合金中镁和铝的质量比是
把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如下图,则合金中镁和铝的质量比是
A.2∶3
B.4∶3
C.4∶9
D.8∶9
7.恒温下,将两个铂电极插入一定量的Na2SO4饱和溶液里进行电解,经过一段时间后,在阳极逸出n mol气体,同时从溶液中析出m g Na2SO4·10H2O晶体,则原Na2SO4溶液的质量分数为
A.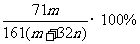 B.
B.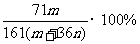
C. D.
D.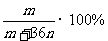
6. 在右图支管中,一管装入2.3g金属钠,一管装入HgO,同时加热两部分,Na完全燃烧 ,若加热后容器里空气成分基本未变,则HgO质量可能是
在右图支管中,一管装入2.3g金属钠,一管装入HgO,同时加热两部分,Na完全燃烧 ,若加热后容器里空气成分基本未变,则HgO质量可能是
A.21.7g B.24g
C.43.4g D.10.85g
5.若某装置(电解池或原电池)中发生反应的离子方程式是:Cu+2H+=Cu2+ +H2↑。则该装置
A.可能是原电池,也可能是电解池
B.只能是原电池,且电解质溶液为硝酸
C.只能是电解池,且金属铜为该电解池的阳极
D.只能是电解池,电解质溶液可以是硝酸
4.某溶液中含有大量的Al3+、NH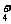 、Ag+、Fe2+四种离子。向该溶液中加入足量Na2O2,微
、Ag+、Fe2+四种离子。向该溶液中加入足量Na2O2,微
热并充分搅拌后,再加入过量稀盐酸,此时溶液中大量存在的阳离子可能是
A.H+、Na+、Al3+、Fe3+ B.Al3+、H+、Na+、Fe2+
C. H+、Na+、Al3+、NH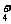 D.Fe3+、Ag+、Na+、H+
D.Fe3+、Ag+、Na+、H+
3.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A.1∶1∶1 B.2∶2∶1 C.2∶3∶1 D.4∶3∶1
2.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合
物叙述正确的是
A.Li2SO4难溶于水 B.Li与N2反应产物是Li3N
C.LiOH易溶于水 D.LiOH与Li2CO3受热都很难分解
1.2006年9月28日,中国科学家研制的“人造太阳”成功地进行了一次放电。所谓“人造太阳”是指受控核聚变。从1 L海水中提取出来的氘( )受控核聚变成氦(
)受控核聚变成氦(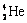 )时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
)时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
A.氘( )受控核聚变成氦(
)受控核聚变成氦(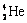 )是一种化学变化
)是一种化学变化
B. 和
和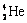 互为同位素
互为同位素
C.符号 中的“2”与符号
中的“2”与符号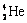 中的“2”意义不同
中的“2”意义不同
D. 2和
2和 2的物理性质、化学性质都存在着很大的差异
2的物理性质、化学性质都存在着很大的差异
25.(8分)将一定量氧化铜粉末加入到100mL0.5mol/L的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10克充分反应后过滤,烘干,得干燥的固体物质仍为10克。
(1)所得溶液的溶质是什么?若最后得到的溶液仍为100mL,其物质的量浓度是多少?
(2)参加反应的铁是多少克?
(3)原来加入的氧化铜质量是多少克?
24.(8分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g)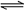 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻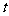 时,
时,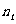 (N2)=13 mol,
(N2)=13 mol, 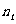 (NH3)=6 mol,计算a的值。
(NH3)=6 mol,计算a的值。
(2)反应达平衡时,混合气体的体积为716.8L(状况下),其中NH3的体积分数为25%。
则平衡时NH3的物质的量为 。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
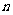 (始):
(始):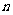 (平)=________________。
(平)=________________。
(4)原混合气体中,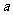 :
: =___________。
=___________。
(5)达到平衡时,N2和H2的转化率之比,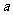 (N2):
(N2):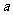 (H2)_______。
(H2)_______。
(6)平衡混合气体中,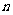 (N2):
(N2):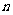 (H2):
(H2):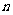 (NH3)_____________。
(NH3)_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com