
18.(10分)实验室常用间接碘量法测定胆矾中铜含量。
实验原理
 在弱酸性条件下,Cu2+与I-作用可生成I2,并被还原成白色的碘化亚铜沉淀;I2溶于过量的KI溶液中:I2+I- I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=
S4O62-+3I-。
在弱酸性条件下,Cu2+与I-作用可生成I2,并被还原成白色的碘化亚铜沉淀;I2溶于过量的KI溶液中:I2+I- I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=
S4O62-+3I-。
实验步骤
第一步:准确称取a g含少量 Fe2(SO4)3胆矾试样。
第二步:将试样置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol/LH2SO4溶液,振荡,得到澄清、透明溶液。
第三步:向第二步得到的溶液中先加少量NaF溶液,再加入足量的10%KI溶液,摇匀。
第四步:盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入淀粉溶液作指示剂。
第五步:将c mol/L Na2S2O3标准溶液装入滴定管。
第六步:滴定,当碘量瓶中溶液由蓝色变为无色且在半分钟内不再变化时,共用去V mL标准溶液。
资料卡片
氧化性:O2 >Fe3+>Cu2+>I2>FeF63-。
讨论下列问题:
(1)第三步操作中,“先加少量NaF溶液”的作用是 ▲ 。
(2)第四步加入淀粉溶液的体积是 ▲ 。
A.1-2 mL B.2-3 mL C.2-3滴
(3)第五步Na2S2O3标准溶液装入滴定管前的必要操作是 ▲ 。
(4)计算:根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= ▲ 。
(5)实验中若用普通锥形瓶替代碘量瓶,测得胆矾试样中铜元素的质量分数为x(Cu),则x(Cu) ▲ ω(Cu) (填“大于”、“等于”或“小于”),你的理由是 ▲ 。
17.(10分) Ⅰ.探究有关物质氧化性的强弱。
Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。
请回答下列问题:
(1)推测实验④中的现象为 ▲ 。
(2)分析上述现象,KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ▲ 。
Ⅱ.探究镁、铝、铁金属单质还原性的强弱。
现有镁条、铝片、铝粉、铁钉、氧化镁、氧化铝、氧化铁、盐酸、稀硫酸、硝酸及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证镁、铝、铁金属单质的还原性强弱。
依据你设计的实验方案,回答下列问题:
(3)实验原理:用化学方程式表示实验中的反应① ▲ 、② ▲ 、③ ▲ …
(4)实验现象:能够充分说明镁、铝、铁金属单质还原性强弱的明显现象是 ▲ 。
(5)实验结论:你得到的实验结论是 ▲ 。
16.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S、T、P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为
A.68.6% B.77.8% C.81.4% D.无法计算
第二卷(非选择题 共86分)
15.微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH―-2e-=ZnO+H2O ,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,下列叙述中正确的是
A.在使用过程中,电池负极区溶液pH增大
B.在使用过程中,电流由Ag2O极经外电路流向Zn极
C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D.外电路中每通过0.2mol电子,正极的质量理论上减小1.6g
14.可逆反应aX(g)+bY(g) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
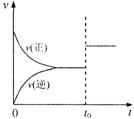 A.若a+b=c,则t0时只能是增大了容器的压强
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是加入了催化剂
D.若a+b≠c,则t0时只能是增大了容器的压强
13.设NA代表阿伏加德罗常数,下列说法正确的是
A.12.4 g白磷中含有P-P共价键个数为0.6 NA
B.100 mL pH = 2的盐酸与醋酸溶液中氢离子数均为2×10-3 NA
C.标准状况下,22.4 L氩气与22.4 L氟气所含质子数均为18 NA
D.1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA
12.四种主族元素的离子aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),
它们具有相同的电子层结构,若m>n,则下列关系能够成立的是
A. 原子序数:a>b>c>d B. a-b=n-m
C.元素非金属性:Z<R D.最高价氧化物对应水化物的碱性:X>Y
11.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,可以得到的正确结论是
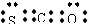 A.羰基硫属于非极性分子
A.羰基硫属于非极性分子
B.羰基硫的电子式为:
C.羰基硫沸点比CO2低
D.羰基硫分子中三个原子处于同一直线上
10.下列离子方程式正确的是
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.Na2S溶液呈碱性:S2-+2H2O H2S+2OH-
H2S+2OH-
C.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH- + HCO3‑ ==CaCO3↓ + H2O
D.等体积等物质的量浓度的NaOH和NH4HSO4溶液混合:H+ + OH- = H2O
9.一定量的的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入
A.Na2SO4固体 B.NaOH固体 C.CH3COONa固体 D.NH4Cl饱和溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com