
0.3molNO,容器内压强为原来的1.1倍。计算:
(1)NO浓度表示的平均化学反应速度
(2)NO2的分解率
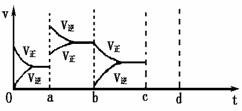
31.(8分)一定温度下有反应2NO2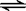 2NO+O2。将0.8molNO2、0.1molO2和一定量的NO
2NO+O2。将0.8molNO2、0.1molO2和一定量的NO
通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有
30.(6分)现有浓度为0.6%的醋酸溶液,其电离度为1%,若此溶液的密度为1g/ml,求溶
液的氢离子浓度
29.(12分)根据如下反应:2I- + CI2 → I2 + 2CI- 和 I2 + 5CI2 + 6H2O → 2HIO3 + 10HCI。人
们从海带中提取碘单质,其提取过程一般需要 种操作方法。为了检验滤液中的碘离子,需要用氯水和淀粉,检验时应先滴入 ,再滴入 ,原因是 。为了确定20ml海带灰的提取液中需加入多少滴氯水,恰好能使碘离子全部变成碘单质,设计了如下的实验:先取1ml海带灰的提取液置于大试管中滴入2滴淀粉溶液,用0.5mol/L 的氯水去滴定,并记下滴入氯水的滴数,当滴到溶液颜色 时停止滴定。假设此时滴入了氯水100滴(滴管滴下的每滴液体为0.05ml),则20ml海带灰的提取液中需加入 滴氯水恰好能使碘离子全部变成碘单质。
20。据此可以判断:元素甲为 ,元素丙为 ,元素乙和丁所形成化合物的分子式为 或 。
28.(8分)在周期表主族元素中,甲元素与乙、丙、丁三元素上下或左右紧密相邻。甲、乙
两元素的原子序数之和等于丙元素的原子序数。这四种元素原子的最外层电子数之和为
27.(8分)当将少量1:1的CH3COOH和CH3COONH4的混合物溶于水后,存在着的电离
或离子反应的平衡有:
(1) ,(2) 。
(3) 。
溶液中离子浓度由大到小的顺序是 。
26.(10分)钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反
应为: Na(1)+KCl(1)  NaCl(1)+K(g)-Q(Q>0)
NaCl(1)+K(g)-Q(Q>0)
该反应的平衡常数可表示为:
各物的沸点与压强的关系见下表。
|
压强(kpa) |
13.33 |
53.32 |
101.3 |
|
K的沸点(℃) |
590 |
710 |
770 |
|
Na的沸点(℃) |
700 |
830 |
890 |
|
KCl的沸点(℃) |
|
|
1437 |
|
NaCl的沸点(℃) |
|
|
1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料转化率可以采取的措施是: 。
(3)常压下,当反应温度升高至990℃时,该反应的平衡常数可表示为:K= 。
25.(12分)(1)A+、B+、C-、D、E五种微粒(分子或离子),它们都分别含有10个电子,已
知它们有如下转化关系; ① A++
C-→D+E, ②B++ C-→2D
A++
C-→D+E, ②B++ C-→2D
Ⅰ、写出①的离子方程式 、②的离子方程式 。
Ⅱ、除外,请再写出二种含10个电子的分子 。
(2)在相同条件下进行某反应的对照实验,相关数据如下:
|
|
Mg的质量 |
酸量 |
开始时反应速率 |
产生H2总量 |
|
Ⅰ |
0.24g |
HCl0.1molL-1100ml |
V1 |
n1 |
|
Ⅱ |
0.24g |
HAc0.1molL-1100ml |
V2 |
n2 |
①试比较有关量的大小:V1 V2,n1 n2 (填“>”“<”“﹦”=,
②现欲改变有关条件,使实验Ⅰ中V1降低,但不改变n1的值,试写出两种可行的方法。
 23.(6分)右图表示在密闭容器中反应:2SO2+O2
23.(6分)右图表示在密闭容器中反应:2SO2+O2 2SO3+Q
2SO3+Q
达到平衡时 ,由于条件改变而引起反
应速度和化学平衡的变化情况,ab过程
中改变的条件可能是 ;bc过程
中改变的条件可能是 ;
若增大压强时,反应速度变化情况画在c-d处。
24.(14分)有a、b两个恒温恒容的密闭容器,a保持容积不变,b中的活塞可上下移动,以保 持内外压强相等.在相同条件下将3molA,1molB分别同时混合于a、b两容器中,发生反应3A(g )+B(g)  2C(g)+D(g)
2C(g)+D(g)
(1)达平衡时,a中A的浓度为M mol· L-1,C的浓度为N mol·L-1,b中A的浓度 为m mol·L-1,C的浓度为n mol·L-1,则M m;N n;(填>、<、=、无法比较)
(2)保持温度不变,按下列配比分别充入a、b两容器,平衡后a中c的浓度为N mol·L- 1的是 ,b中c的浓度为n mol·L-1的是
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1molD
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
(3)若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为Wmol·L-1,C的浓度为Ymol·L-1,则W和M,Y和N之间的关系为W M、Y N.
(4)保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为Rmol·L-1则
A.R=2M B.R<M C.M<R<2M D.R>2M
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com