
2.下列说法错误的是
A. 血液中的血细胞直径在1-100nm之间,所以血液是胶体
B. 糖类是具有甜味的物质
C. 碘和干冰升华时,克服的粒子间作用属于同一类型
D. 氯化铵的水解反应可看作是盐酸与氨水反应的逆反应
1.下列说法错误的是
A. 乙醇分子中-OH与水分子中-OH相近,因此乙醇与水有些性质相似
B. 生命体中许多大分子内存在氢键,如DNA的两个螺旋链是用氢键相互结合的
C. 1个苯分子中,存在3个碳碳双键和3个碳碳单键
D. 卤族元素原子中,与氢原子形成最强极性键的原子是氟原子
26.(6分)
Ⅰ 在某压强恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol。达到平衡时,体积为反应前的三分之二。求:
2NH3(g);ΔH=-92.4 kJ/mol。达到平衡时,体积为反应前的三分之二。求:
(1)达到平衡时,N2的转化率为_______________。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:(1)________(2)(填“>”、“<”或“=”)。
Ⅱ 若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡。试比较平衡时NH3的浓度:Ⅰ________Ⅱ (填“>”、“<”或“=”)。
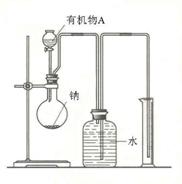
25.(4分)12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 g CO2。测得有机化合物A的蒸气与H2的相对密度是30,求:
(1)有机物A的分子式______________。
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况): a mL(密度为ρ g/cm3 )的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为_________________(可以不化简)。
24.(8分)咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。

(1)咖啡酸中含氧官能团的名称为___________________________________________。
(2)咖啡酸可以发生的反应是____________________________________(填写序号)。
① 氧化反应 ② 加成反应 ③ 酯化反应 ④ 加聚反应 ⑤ 消去反应
(3)咖啡酸可看作1,3,4-三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为________________________________。
(4)3.6 g咖啡酸与足量碳酸氢钠反应生成气体(标准状况)______________mL。
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为
__________________________________________________________。
23.(8分)北京东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。
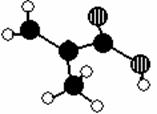
(1)该产品的结构简式为__________,分子式为___________________。
(2)下列物质中,与该产品互为同分异构体的是__________(填序号),与该产品互为同系物的是____________(填序号)。
①CH3CH=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(3)在一定条件下,该产品跟乙二醇反应可得到分子式为C6H10O3的物质,该物质发生加聚反应可得到用来制作隐形眼镜的高分子材料,这种高聚物的结构简式为____________________。
22.(10分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
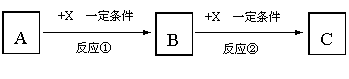
试回答:
(1)若X是强氧化性单质,则A不可能是________________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)_________________________________________,检验此C溶液中金属元素价态的操作方法是___________________________________。
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为_____________,X的化学式可能为(写出不同类物质)_________或_________,反应①的离子方程式为____________________________或___________________。
21.(10分) A、B、C、D、E为短周期元素,原子序数依次增大。其中A与E同主族,B的最外层电子数是次外层电子数的2倍,C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X。
A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价键。
(1)C元素在周期表中的位置是________,写出B的最高价氧化物的电子式__________。
(2)X的水溶液显______________(填“酸”、“碱”或“中”)性,理由是(用离子方程式表示)____________________________________________,溶液中各种离子浓度由大到小的顺序为____________________________________________。
(3)A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为______________。
(4)火箭推进器中装有液态的C2A4和液态A2D2,它们发生化学反应时生成气态C单质和水蒸气,并放出大量的热。已知0.4 mol液态C2A4跟液态A2D2完全反应时,放出256.6kJ热量,该反应的热化学方程式为________________________________。
20.(6分)目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)电解法制烧碱的主要原料是饱和食盐水。由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须经过精制才能进行电解。除去这些杂质时,不应选用的试剂是_______(填序号)。
a.BaCl2 b.Na2CO3 c.NaOH d.盐酸 e.KOH
(2)现有200 mL食盐水,用石墨电极电解。当阴极产生气体的体积为0.224 L(标准状况)时停止电解,阳极的电极反应式为__________________________________________,
电解后,溶液在常温下的pH约为____________________(忽略体积变化)。
19.(4分)铁酸钠(化学式为Na2FeO4)是一种新型净水剂,工业上常通过如下化学反应制取:
Fe2O3+3NaNO3+4NaOH=2Na2FeO4+3NaNO2+2H2O。
(1)反应中,氧化剂为____________________。
(2)当生成4 mol Na2FeO4时,电子转移总数为___________mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com