
21.(10分)从固体混合物A出发可以发生如下框图所示的一系列变化:
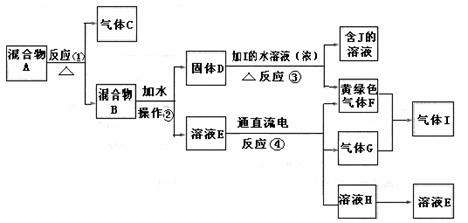
(1)在实验室中收集气体C,可选择下图装置中的 (填选项字母)。

(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:
反应①的化学方程式: ;
反应③的离子方程式: 。
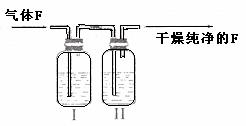
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过右图中的装置,其中瓶
Ⅰ中盛放的是 ,瓶Ⅱ中盛放的是 。
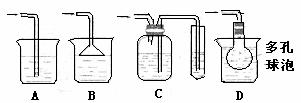
(5)实验中必须吸收多余的尾气,以免污染空气。下图是实验室用NaOH溶液吸收气体F的装置,为防止产生倒吸现象,最合理的装置是 (填选项字母)。
20.(12分)已知 (注:R、R’为烃基)
(注:R、R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化:
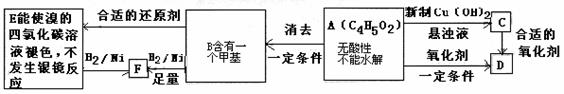
试回答:
(1)写出符合下述条件A的同分异构体的结构简式(各任写一种):
a.具有酸性 ,b.能发生水解反应 。
(2)A分子中的官能团是(写名称) ,D的结构简式是 。
(3)E→F的反应类型是 (写编号)。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出A→B化学方程式 。
(5)写出E在一定条件下生成高聚物的化学方程式
。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的G,写出G的结构简式 。
19.(12分)A-N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
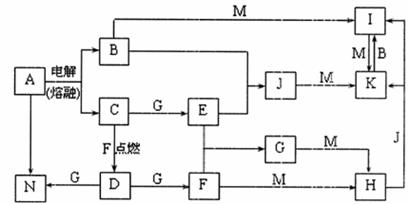
(1)H的化学式为 ,D的电子式为 。
(2)B与N反应的离子方程式为 。
(3)D与G反应的化学方程式为 。
(4)I可用于净化水,其原因是
(用相关的反应方程式和简要文字回答)。
(5)通常状况下,1摩尔气体E在气体F中完全燃烧生成液态G时放出的热量为a kJ,请写出表示E燃烧热的热化学方程式 。
(6)I与NaOH溶液反应生成的沉淀再与NaOH和NaClO的混合液作用,是制备理想的绿色水处理剂(Na2MO4)的一种方法,
试写出此反应的化学方程式 。
18.(13分)如图所示,若电解5 min时,铜电极质量增加2.16g。
试回答:
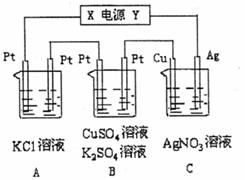
(1)电源电极X名称为 (填“正极”或“负极” )。
(2)电解池中溶液的pH变化:B ,C (填“增大”、“减小”或“不变”)。
(3)B中阳极的电极反应式为 ;若通电5 min时B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度约为 。
(4)A中发生反应的化学方程式为 ,
若A中KCl溶液的体积也是200mL,电解后溶液的pH= 。
(5)若将C装置单独取出,导线连接铜、银后,请写出负极的电极反应式
。
17.(11分)短周期元素A、B、C、D中,0.5molA元素的离子得到6.02×1023个电子后被还原为中性原子,0.4gA的氧化物恰好与100mL 0.2mol/L 的盐酸完全反应,A元素原子核内质子数与中子数相等;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)A、B、C、D四种元素的符号A ,B ,C ,D 。
(2)通常状况下,A、B、C、D四种单质中属于金属晶体的是 (填写物质名称,下同),属于原子晶体的是 。
(3)C、D两元素组成的物质,分子内含有 键(填“极性”或“非极性”,下同),其分子为 分子。
(4)A、B、C三种元素的离子半径由大到小的顺序为: (用离子符号表示)。
16.相对分子质量为M的某物质在室温下的溶解度为S,此时测得饱和溶液的密度为d g/cm3,则该饱和溶液的物质的量浓度是
A.  mol/L B.
mol/L B. mol/L
mol/L
C. mol/L
D.
mol/L
D. mol/L
mol/L
第Ⅱ卷(非选择题,共58分)
本卷共5小题,共58分。
15.下列实验设计、操作或分析合理的是
①完成中和热测定的实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替;
②实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂;
③在测定硫酸铜晶体的结晶水含量时,加热过程中不慎有晶体飞溅出来,将会造成测定结果偏高;
④用食醋和澄清石灰水验证蛋壳中含有碳酸盐;
⑤用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子。
A.②③④ B.①③⑤ C.①②④ D.②③⑤
14.常温时,将a1mL,b1mol/L 的CH3COOH溶液加入到a2mL,b2mol/L 的NaOH溶液中,下列结论中不正确的是
A.如果a1b1=a2b2,则混合溶液的pH>7
B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C.如果a1=a2,b1=b2,则混合液液中c(CH3COO-)=c(Na+)
D.如果a1=a2,且混合溶液的pH<7,则b1>b2
13.下列实验过程中产生的现象与对应的图像符合的是
|

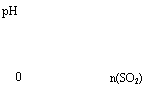

A.NaHSO3粉末加入HNO3溶液中 B.SO2气体通入溴水中
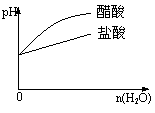
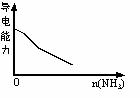
C.pH=2的醋酸与盐酸溶液分别加水稀释 D.氨气通入醋酸溶液中
12.某温度下,在一容积可变的密闭容器里,反应2A(g) 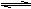 B(g) + 2C(g)达到平衡时,
B(g) + 2C(g)达到平衡时,
A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
A.充入1mol稀有气体氦(He),平衡将不发生移动
B.充入A、B、C各1mol,平衡将向正反应方向移动
C.将A、B、C各物质的物质的量都减半,C的百分含量不变
D.加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com