
3.下列各组化合物中,均能由单质直接化合而得到的是
A.NH3、CuS、SO2、FeS B.SO3、Cu2S、NO、FeCl3
C.FeCl3、SO2、NO、Cu2S D.FeCl2 、FeS、SO2、NH3
2.大理石可以用作墙面、地面和厨房桌面,食醋不慎滴在大理石桌面上,会使其失去光泽,变得粗糙。下列能正确解释此现象的是
A. 食醋中的水使碳酸钙溶解
B. 食醋中的醋酸将碳酸钙氧化
C. 食醋中的醋酸与碳酸钙反应并放出大量的二氧化碳气体
D. 食醋中的醋酸与碳酸钙发生了复分解反应
1.下列化学名词正确的是
A.乙酸乙脂 B.石碳酸 C.三溴笨酚 D.烧碱
31.(6分)
含CN- 的废水有剧毒,可用液氯在碱性条件下将其氧化成OCN-,OCN- 再进一步被氧化为无毒物质。有关反应如下:
⑴ KCN+2KOH+Cl2 → KOCN+2KCl+H2O被氧化的元素是 。
⑵ 写出KOCN在KOH溶液中与氯气反应生成无毒物质的化学方程式:
。
⑶ 某厂废水中含KCN,其浓度为650mg / L,该废水的密度为1 g/mL。现用氯氧化法处理,该厂每日处理上述废水20t,使KCN完全转化为无毒物质,每天至少需液氯 kg(保留到小数点后1位)。
30.(6分)
向1.0 L pH = 12的Ba(OH)2溶液中,逐滴加入1.25×10-3 mol/L 的NaHSO4溶液,使溶液中的Ba2+ 恰好完全沉淀时(忽略溶液混合时体积的变化),所得溶液pH = ,发生反应的离子方程式为: 。当溶液呈中性时,加入NaHSO4溶液的体积是 L。
29.(15分)
亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+ 34%-36% ,是薄衣片,……,与VC(维生素C)同服可增加本品吸收。
某同学设计实验对其中的铁成分进行了验证。请一起完成该实验:
第一步:查阅资料得知,双氧水可以氧化SCN- 生成N2、CO2和SO42-,也可以将Fe2+氧化成Fe3+。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有 离子存在(填离子符号);
第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+离子存在。该离子存在的原因可能是(填序号):
①药品中的铁本来就是以三价铁的形式存在;②在制药过程中生成少量三价铁;③本实验过程中有少量三价铁生成。
第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示):
;
溶液红色又褪去的原因可能是:
;
请自选中学实验室中常用仪器、药品,设计实验证明你的推测:
;
第六步:向B试管的溶液中加入一片VC片,片刻后溶液红色也褪去,说明VC有 性;怎样理解药品说明中所述“与VC同服可增加本品吸收”这句话?
。
28.(3分)
下列实验或操作不合理的是
①用FeCl3溶液鉴别乙醇溶液和苯酚溶液
②用溴水检验汽油中是否含有不饱和脂肪烃
③浓硫酸不慎沾到皮肤上,立即用大量水冲洗
④用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
⑤仅用蒸馏水鉴别蔗糖、硫酸铜粉末、碳酸钙粉末
⑥用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH
⑦配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯
⑧在250mL 烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
A.①③⑤⑥ B.③④⑦⑧ C.②④⑤⑧ D.①③④⑦
27.(16分)
一种名为“苹果醋(ACV)”的浓缩饮料多年来风靡全美。ACV是一种由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效。苹果酸是这种饮料的主要酸性物质,分离提纯后对苹果酸的分析如下:
⑴其相对分子质量不超过140;
⑵元素分析证明仅含C、H、O三种元素,各元素的质量分数为 C:35.82%,H:4.48%,其余为O元素;
⑶0.001mol苹果酸与足量NaHCO3反应放出44.8mLCO2,若等量该酸与足量金属Na在一定条件下充分反应则放出33.6mLH2(气体体积均已经折算为标准状况);
⑷结构分析表明,苹果酸中所有碳原子在一条主链上。
回答下列问题:
①苹果酸的分子式为: ;
②写出苹果酸在一定条件下分子内脱水得到的链状产物的结构简式: ,该产物中含有的官能团的名称是: ,该反应的类型属于: ;
苹果酸在一定条件下进行分子内脱水时是否还能得到其他可能的产物,有的话请写出其产物的任意一种结构简式,没有其他产物则此问不填: ;
③写出苹果酸一定条件下与足量Na反应的化学方程式:
;
④写出苹果酸与碳酸氢钠溶液反应的化学方程式:
。
26.(10分)
在一定条件下,N2和H2发生如下反应:N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol
(1)该反应中△H的含义是(填序号): 。
①该反应达到平衡时放出的热量
②该反应达到平衡时吸收的热量
③该条件下,N2与H2反应生成2molNH3时放出的热量
④该条件下,N2与H2反应生成2molNH3时吸收的热量
(2)达到平衡后,在其他条件不变的情况下降低温度,H2的转化率________________,化学反应速度_______________(填“增大”、“减小”或“不变”)。
(3) 500℃时,在一密闭容器中,将N2和H2混合,反应过程中N2、H2、NH3物质的量变化如图,反应处于平衡状态的时间是: 。
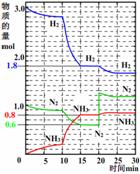
(4)据图判断,反应进行至15 min时,NH3的体积分数为: (保留到小数点后2位);反应进行至20 min时,曲线发生变化的原因可能是: (用文字表达);10 min到15 min时曲线变化的原因可能是_________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加NH3的物质的量
25.(20分)
下表中的实线表示元素周期表的部分边界。①-⑧分别表示元素周期表中对应位置的元素。
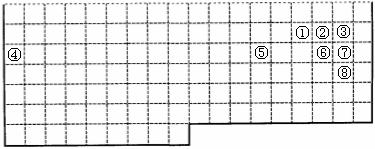
⑴请在表中用实线补全元素周期表边界。
⑵元素周期表体现了元素周期律,元素周期律的本质是 。
⑶元素③④⑤⑥的原子半径由大到小的顺序是: 。
元素⑤、⑥的最高价氧化物对应的水化物的酸性强弱为:____>____(用化学式表示)。
⑷元素③⑦⑧的氢化物的沸点由高到低的顺序为: (用化学式表示)。
⑸元素①的氢化物的电子式为___,该分子属于(填“极性”或“非极性”) 分子。
⑹元素⑤在生产生活中有重要用途。写出工业制取其单质的化学方程式: 。
元素⑤与⑦形成的化合物有净水作用,写出其与水作用的离子方程式: 。
⑺元素④与⑦形成的化合物是一种重要的工业原料,写出工业电解其水溶液时的离子方程式: 。
⑻已知一定条件下,1mol ⑥的固态单质在②的单质中充分反应放热297kJ。写出此条件下该反应的热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com