
1. 取三张蓝色石蕊试纸置于表面皿上,然后按顺序滴加65%的硝酸,98.3%的硫酸和新制氯水,三张试纸最终呈现的颜色是( )
A. 白、红、白 B. 红、黑、红
C. 红、红、红 D. 白、黑、白
32.(10分)有一硝酸盐晶体,其化学式表示为M(NO3)x·nH2O经测定其摩尔质量为242g· mol-1。取1.21g该晶体溶于水配成100mL溶液。将此溶液倒入右图所示装置中,用石墨作电极进行电解。当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g。回答:
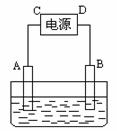
⑴金属M的原子量为________,n = ______。
⑵ C极为 极,A极的电极反应式为________________。
⑶ 电解后溶液的pH为(设电解前后溶液的体积不变) 。
31.(10分)某温度(T℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)= 10-y mol·L-1,x与y的关系如右图所示,请回答下列问题:
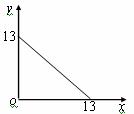
⑴ 此温度下,水的离子积Kw为__________,则该温度T________25℃(填“>”、“<”或“=” ,
pH=7的溶液显_________(填“酸”、“碱”或“中”)性。
⑵ 若将此温度(T℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
①若所得混合液为中性,则a∶b=____________;
②若所得混合液的pH=2,则a∶b=____________。
30.(10分)用右图装置进行实验,将A逐滴加入B中:
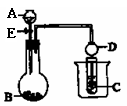

⑴ 若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应,C为品红溶液,实验中观察到溶液褪色,则B是____________(写化学式),根据题意写出B与浓H2SO4反应的化学方程式__________________________________;
反应后往烧杯中加入沸水,又可观察到试管C中的现象为____________________。
⑵ 若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是_________________________,25℃时等物质的量浓度的B、C两溶液pH大的是_____________(填化学式);然后往烧杯中加入沸水,可观察到试管C中的现象是_______________________。
⑶ 若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是_______________(写名称),C是________________(写化学式)与乙醛的混合液,乙醛发生反应的化学方程式为___________________________,仪器D在此实验中的作用是_____________________。
29.(4分)A、B、C、D是四种可溶性化合物,分别由阳离子K+、Ba2+、Al3+、
Fe3+和阴离子OH-、CO32-、NO3-、SO42-两两组合而成,它们的溶液发生如下反应:A与B反应生成白色沉淀,再加过量的A沉淀部分溶解;C与D反应生成有色沉淀,并放出无色气体;B与C反应生成白色沉淀,也放出无色气体。写出它们的化学式:
A____________、B_____________、C_____________、D_____________。
28.(6分)烷烃A只可能有三种一氯取代产物B、C和D。C的结构简式是
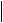 (CH3)2CCH2Cl
(CH3)2CCH2Cl
CH2CH3 。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E,以上反应及B的进一步反应如下图所示。
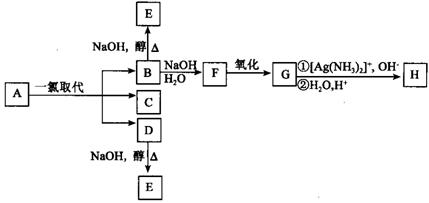
请回答:
⑴ A的结构简式是_________________。
⑵ H的结构简式是_______________________。
⑶ B转变为F的反应属于______________反应(填反应类型名称)。
⑷ B转变为E的反应属于______________反应(填反应类型名称)。
⑸ 写出下列反应的化学方程式:
F→G:_________________________________________________________。
⑹ 1.16 g H与足量NaHCO3作用,标准状态下可得到CO2的体积是________mL。
27.(10分)现有八种有机物:A乙醇、B甲苯、C苯酚、D苯甲酸、E葡萄糖、F溴乙烷、G乙酸、H乙烯,其中:
⑴ 能跟银氨溶液发生银镜反应的是 (填写序号,下同)。
⑵ 能使氯化铁溶液变紫色的是 。
⑶ 在常温下能跟浓溴水反应产生白色沉淀的是 。
⑷ 在一定条件下能跟羧酸发生酯化反应的是 。
⑸ 在一定条件下能跟氢氧化钠水溶液反应的是 。
26.(10分)A、B、C、D、E为五种常见的短周期元素,常温下A、B可形成B2A2和B2A两种液态化合物,B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性恰好相反,C元素的焰色反应呈黄色,E与C同周期,且E的阳离子在其所在周期元素形成的简单离子中半径最小,试回答:
⑴ D元素处于周期表的第_____________族;
⑵ B2A2对应化合物的结构式为_______________,Y的电子式为_______________;
⑶ 液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X的电离方程式为____________________________________________________;
⑷ A、D、E三种元素形成的盐(化学式为A9D3E)的水溶液呈________性,用离子方程式解释其原因______________________________________________________;
⑸ W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,W的水溶液呈碱性,Q的水溶液呈酸性,且物质的量浓度相同的W、Q溶液中水的电离程度:前者小于后者,则W为______________,Q为_______________(填化学式)。
⑹ 用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池的电极反应方程式:
负极_______________________;正极_____________________________。
25.在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH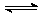 CH3COO-+ H+
CH3COO-+ H+
对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
第 Ⅱ 卷 (非选择题,共50分)
24. 设NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol H2O2完全分解时转移电子数为2 NA
B.标准状况下,11.2 L SO3所含的分子数为0.5 NA
C.28 g乙烯与28 g丙烯中均含共用电子对数为6 NA
D.100 mL 0.1 mol·L-1AlCl3溶液中,所含Al3+数为0.01 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com