
6.两种短周期元素组成的化合物中,原子个数比为1:3。若两种元素的原子序数分别为a和b,则a和b的关系可能是 ( )
①a = b+5 ②a + b =8 ③a + b = 30 ④a = b+ 8
A.①②③④ B.②③④ C.只有②③ D.只有③④
5.下列事实中,能说明氯元素原子得电子能力比硫元素原子强的是 ( )
①HCl的溶解度比H2S大 ②盐酸的酸性比氢硫酸(H2S水溶液)酸性强 ③HCl的稳定性比H2S大 ④HCl的还原性比H2S强 ⑤HClO的酸性比H2S强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧在元素周期表中Cl处于S同周期的右侧 ⑨还原性:Cl-< S2-
A.③④⑤⑦⑧⑨ B.③⑥⑦⑧ C.③⑥⑦⑧⑨ D.①②③④⑤⑥⑦⑧⑨
4.下列基本实验操作或对实验事实的叙述中正确的是 ( )
A.硫黄保存在二硫化碳中,碱金属要保存在煤油中
B.为了实验安全,做氢气还原氧化铜实验是,先检验氢气纯度后再向试管中通气体
C.为了提高实验准确度,用量筒量取一定量硫酸时,倒出硫酸后再用蒸馏水洗涤量筒,并将洗涤液倒入所量取的溶液中
D.浓硫酸不小心沾在皮肤上,立即用布拭去,再用大量水冲洗,最后涂上3%~5%的碳酸氢钠溶液
3.酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种化学式为C6H14O的物质。对于此过程,以下分析中不正确的是 ( )
A.C6H14O分子含有羟基
|
C.实验小组分离出的酯可表示为CH3COOC6H13
D.不需要催化剂,这种酯在水中加热即可大量水解
2.加成反应是有机化合物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应。下列过程与加成反应无关的是 ( )
A.苯与溴水混合振荡,水层颜色变浅
B.裂化汽油与溴水混合振荡,水层颜色变浅
C.乙烯与水在一定条件下反应制取乙醇
D.乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷
1.SK-Ⅱ是一种非常有名的美容化妆品,在国家质检总局的质量检查中,查出SK-Ⅱ含有微量的铬。日常生活中大量使用的不锈钢也是含铬的铁合金,化合态的铬是重金属离子,对环境有严重的污染,化妆品中微量的铬也会对人体皮肤造成较大伤害。下列关于铁和铬的说法不正确的是 ( )
A.工业上可用铝热反应冶炼铬
B.铬和铁的最高价氧化物对应水化物显强碱性
C.铬和铁均为过渡元素,位于第四周期
D.含铬的工业废水不能直接排放
20.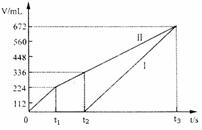 (7分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(7分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液时pH。
19.(10分)能源是人类社会发展进步的物质基础,在当代,能源、信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃10kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧的热化学方程式:
。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.100g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.200mol·L-1的K2Cr2O7溶液,再用0.3000mol·L-1(NH4)2
Fe(SO4)2标准溶液滴定,耗去此标准液20.200mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+
CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
。
②盛装(NH4)2Fe(SO4)2标准溶液的应为 (“酸式”或“碱式”)滴定管。如果达滴定终点时,仰视读数,则读数偏 。(“大”或“小”)
③此工业甲醇中CH3OH的质量分数 。
18.(10分)“智能型”大分子在生物工程中有广泛的应用前景。PMAA就是一种“智能型”大分子,可用于生物制药中大分子与小分子的分离,下列是以物质A为起始反应物合成
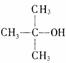
PMAA的路线。已知 结构相似的醇不能被氧化为醛或酸。
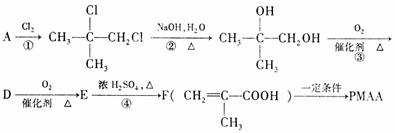
根据上述过程回答下列问题:
(1)写出结构简式:A PMAA
(2)写出上述过程中的反应类型:① ④
(3)写出③的化学方程式
17.(9分)饱和氯水与石灰石的反应是制取较浓的HclO溶液方法之一,某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去。
②过滤,将滤液滴在有色布条上,发现其漂白性更强。
③为了确定反应产物,将滤液分为三份,分别进行以下实验。
第一份与石灰水混合,立即产生大量白色沉淀。
第二份与稀盐酸混合,立即产生大量气泡。
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述这验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因
。
(2)写出步骤③中第二份滤液发生反应的离子方程式:
第二份: 。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有其它溶质为(写化学式) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com