
4. 设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A. 1L 1mol·L-1醋酸溶液中离子总数为2NA
B. 0.1molK2O2与水反应时,转移的电子数为0.2NA
C. 46g NO2和N2O4混合气体中含有原子数为3NA
D.含有5.3gNa2CO3的溶液中,有0.05NA 个CO32-离子
3.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质: ① FeCl3 ② Fe2O3 ③ Cu(NO3)2
④ KNO3,铜粉可以溶解的是 ( )
A.只有①或② B.只有②或④
C.只有①或②或③ D.都可以
2.同位素、同素异形体、同系物、同分异构体,这些关系都不存在的是 ( )
①淀粉和纤维素 ②红磷和白磷 ③乙醇和甲醚 ④苯酚和苯甲醇
A. ① B. ② C. ①④ D. ③④
1.下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是( )
A.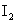 B.
B.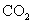 C.
C.
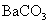 D.
D.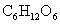 (葡萄糖)
(葡萄糖)
31.(6分)
金属锡(Sn)的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为:Sn+2HC1====SnC12+H2↑,再加入过量FeC13溶液,发生如下反应:SnC12+2FeC13====SnC14+2FeC12最后用已知浓度K2Cr2O7cy溶液滴定生成的Fe2+离子,反应的化学方程式为:6FeC12+K2Cr2O7+14HC1====6FeC1+2CrCl32KC13+7H2O,现有金属锡试样0.613克,经上述各步反应后,共用去0.100mol/LK2Cr2O7溶液16.0毫升,求试样中锡的百分含量(假定杂质不参加反应)。
30.(6分)
400K、101.3kPa时,L1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L (同温同压下测定)。
(1)该烃在组成上必须满足的条件是
(2)当a = 10L时,该烃可能的分子式为
(3)当该烃的人子式为C7H8时,a的取值范围为 。
29.(4分)
下列各单质(A、B、C)和化合物(甲、乙、丙、丁)之间有以下的转化关系,而且各单质和化合物的组成元素皆为短周期元素。
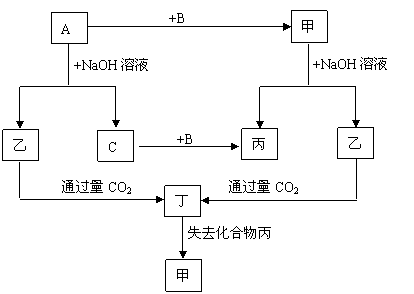

试推断各化合物的化学式为:甲 、、乙 、、丙 、、丁 、。
28.(10分)
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4倍。A、B、D、E这四种元素,每种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)写出B、C、D、E元素的元素符号:B C D E
(2)A、B、C、E四种元素可形成两种酸式盐,这两种酸式盐的化不式为 、、 、;这两种酸式盐在溶液中相互反应的离子方程式为
(3)由A、C、D三种元素形成化合物的电子式为 ,其中含有的化学键为
(4)用电子式表示化合物A2E的形成过程
27.(8分)
某化学课外小组所做实验的示意图如下:
 上图中“→”表示所体流向,M是一种纯净而干燥的气体,Y为另一种气体,E内有棕色产生,实验所用的物质,只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaC12、(NH4)2CO3、碱石灰固体及蒸馏水,据此实验,完成下列填空:
上图中“→”表示所体流向,M是一种纯净而干燥的气体,Y为另一种气体,E内有棕色产生,实验所用的物质,只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaC12、(NH4)2CO3、碱石灰固体及蒸馏水,据此实验,完成下列填空:
(1)A中所用装置的主要仪器有
(2)B中所选的干燥剂是 其作用是
(3)C中发生的主要反应的化学方程式是
(4)D装置中发生反应的离子方程式为
26.(6分)
实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
(1)实验中除了烧杯、量筒外还需要的其它仪器有: 。
(2)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸体积为 mL。(计算结果保留一位小数)
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作:
A.量取浓硫酸的量筒内有少量少;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中;
C.住容量瓶转移是,有少量液体溅出
D.将量筒洗涤后洗涤液一并转入容量瓶
E.定容时仰视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有 ;无影响有
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com