
18. 入Na2CO3溶液,有白色沉淀生成,证明________离子存在,排除_______________________离子存在。 ⑸根据以上实验事实确定: ①该溶液中肯定存在的离子是____________________________; ②肯定不存在的离子是_____________________________________, ③还不能肯定是否存在的离子是___________________________________。
17. (8 分)下列各图所示装置或实验方法均有错误,请指出错误所在,不另画图。
⑴H2的干燥 ⑵将溶液稀释到500mL
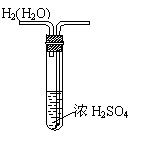

 错在______________ 错在__________________________
改正的方法___________
观察点如图,继续加水至刻度线时
浓度将偏(填大或小)____________
⑶NaHCO3分解实验 ⑷称量KNO3
错在______________ 错在__________________________
改正的方法___________
观察点如图,继续加水至刻度线时
浓度将偏(填大或小)____________
⑶NaHCO3分解实验 ⑷称量KNO3

 错在_________________ 错在______________
KNO3的实际质量为_____________[xv]
错在_________________ 错在______________
KNO3的实际质量为_____________[xv]
(8分)有一瓶澄清溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验: ⑴用pH试纸检验,表明溶液呈强酸性,排除______________离子的存在。 ⑵取出部分溶液,加入少量CCl4 及数滴新制氯水,经振荡,CCl4 层呈紫红色,排除_____离子的存在。 ⑶另取部分溶液,逐滴向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生,则可排除________________离子的存在,取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。 ⑷另取部分上述碱性溶液,向其中加
16. T℃时,A、B、C三种气体在一密闭容器中发生反应的情况如图Ⅰ所示,若保持其他条件不变,温度分别为T1和T2时,A的体积分数与时间的关系如图Ⅱ所示。则下列结论正确的是( )

 A.该反应的热化学方程式为:2A(g)+B(g)
A.该反应的热化学方程式为:2A(g)+B(g)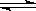 2C(g);△H>0
B.在(t1+20)s时,保持温度和压强不变,向密闭容器中充入一定的He,平衡不移动
C.其他条件不变,升高温度,正、逆反应速率均增大,且B的转化率增大
D.若保持容器容积和温度不变,在0-t1时间里,正反应速率始终大于逆反应速率,在
t1时刻正逆反应速率相等,之后,逆反应速率大于正反应速率
2C(g);△H>0
B.在(t1+20)s时,保持温度和压强不变,向密闭容器中充入一定的He,平衡不移动
C.其他条件不变,升高温度,正、逆反应速率均增大,且B的转化率增大
D.若保持容器容积和温度不变,在0-t1时间里,正反应速率始终大于逆反应速率,在
t1时刻正逆反应速率相等,之后,逆反应速率大于正反应速率
第Ⅱ卷(非选择题 共62分)
15. 将0.1mol铜与40mL 10mol·L-1的HNO3充分反应后,溶液中含amol H+ ,由此可知( ) A.生成的气体在标准状况下的体积为4.48L B.生成的气体在标准状况下的体积为1.49L C.被还原的硝酸的物质的量为(0.2-a)mol D.反应后溶液中所含NO3- 的物质的量为0.2mol[xiv]
14. 在一密闭容器中,反应mA(g)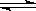 nB(g)+nC(g)达到平衡后,保持温度不变,将容器体积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则(
)
A.平衡向正反应方向移动了 B.物质A的转化率增加了
C.物质C的质量分数增加了 D.m<2n[xiii]
nB(g)+nC(g)达到平衡后,保持温度不变,将容器体积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则(
)
A.平衡向正反应方向移动了 B.物质A的转化率增加了
C.物质C的质量分数增加了 D.m<2n[xiii]
13.  如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B组合不可能是下列的( )
A.NaOH溶液、CO2
B.H2O、NH3
C.NaOH溶液、NO
D.H2O、NO2
[xii]
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B组合不可能是下列的( )
A.NaOH溶液、CO2
B.H2O、NH3
C.NaOH溶液、NO
D.H2O、NO2
[xii]
12. 在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(mol·L-1·s-1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系:υ(B)=3υ(A);3υ(C)=2υ(B)。则此反应可表示为( )
A.2A+3B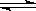 2C B.A+3B
2C B.A+3B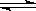 2C
C.3A+B
2C
C.3A+B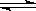 2C D.A+B
2C D.A+B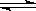 C[xi]
C[xi]
11. 25℃时,向1mL pH=a的盐酸中滴加10mL pH=b的NaOH溶液,当溶液中n(Cl-)=n(Na+)时,则a+b的值为( ) A.13 B.14 C.15 D.不能确定[x]
10. 已知次碘酸(HIO)既能和酸发生中和反应又能和碱发生中和反应。它与盐酸发生反应将生成( ) A.HI B.IOCl C.HClO D.ICl[ix]
9. 下列离子方程式书写正确的是( )
A.四氧化三铁溶于氢碘酸溶液中:Fe3O4+8H++2I- 3Fe2++I2+4H2O
B.向次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2
3Fe2++I2+4H2O
B.向次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2 CaCO3↓+2HClO
C.氟气通入水中:2F2+2H2O
CaCO3↓+2HClO
C.氟气通入水中:2F2+2H2O 4H++4F-+O2↑
D.铜与稀硝酸反应:Cu+4H++2NO3-
4H++4F-+O2↑
D.铜与稀硝酸反应:Cu+4H++2NO3- Cu2++2NO2↑+2H2O [viii]
Cu2++2NO2↑+2H2O [viii]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com