
6.下列各组离子在水溶液中能大量共存的是 ( )
A.pH = 12的溶液中:Na+、K+、SO42 -、HCO3 -
B.常温下,由水电离出的c(H+)= 10-12mol/L的溶液中:K+、Na+、ClO -、S2 –
C.Fe3+、K+、Cl -、SCN -
D.Mg2+、Al3+、NO3 -、Cl –
5.下列离子方程式书写正确的是 ( )
A.次氯酸钙溶液中通入过量的二氧化碳
Ca2++2ClO - +H2O+CO2 = CaCO3↓+2HClO
B.氯化铁溶液中通入硫化氢气体
2Fe3++S2-
2Fe2++S
C.碳酸氢钙溶液中加入过量的氢氧化钠溶液
HCO3
- +OH - CO32-+H2O
D.氯化亚铁溶液中加入硝酸
3Fe2++4H++NO3-
3Fe3++2H2O+NO↑
4.在甲酸溶液中加入一定量的NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是 ( )
A.c (OH -)<c (H+) B.c (HCOO -)>c (Na+)
C.c (OH -)>c (HCOOH) D.c (OH -)<c (HCOO -)
3.新弹性材料丁苯吡橡胶的结构简式为
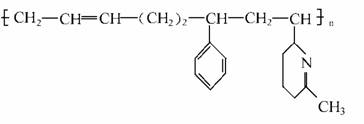
其单体可能是以下物质中的某几种:
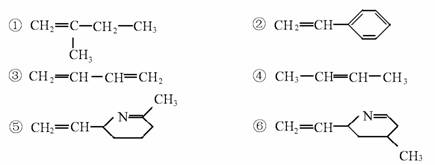
其中正确的一组单体是 ( )
A.①②③ B.②③⑤ C.①②⑥ D.②④⑥
2.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.11.2L氨气所含有的分子数一定是0.5NA
B.1L 1mol/L的盐酸中,所含氯化氢分子数为NA
C.常温常压下,1mol羟基(-OH)所含电子数为9NA
D.标准状况下,1L乙醇完全燃烧生成CO2的分子为
1.世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。ClO2消毒自来水的效率是相同质量氯气的2.63倍。下列说法中不正确的是 ( )
A.ClO2是强氧化剂
B.ClO2是共价化合物
C.ClO2中氯的化合价为+4
D.ClO2消毒时的还原产物是氯气
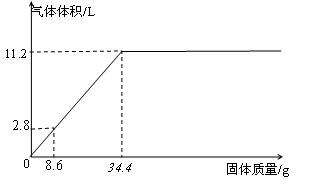
22. (9分)在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系。试计算:
⑴NaOH溶液的物质的量浓度是_________________;
⑵当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体体积为_________L(标准状况);
⑶当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体体积为_________L(标准状况)。
[xii]
[xiii]
[xiv]
21. (12分)T℃时,有甲、乙两个容积固定的密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6molA和3molB,发生反应如下:3A(g)+bB(g) 3C(g)+2D(g);△H<0;4min后甲容器内的反应达到平衡,A的浓度为2.4mol·L-1,B的浓度为1.8mol·L-1;t min后乙容器内的反应达到平衡,B的浓度为0.8mol·L-1。根据题给的信息回答下列问题:
⑴甲容器中反应的平均速率υ(B)=_______________,化学方程式中计量数b=______。
⑵乙容器中反应达到平衡所需时间t___________4min(填“>”、“<”或“=”),原因是______________________________________________________。
⑶T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8mol·L-1,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是__________________、_____________________。
⑷若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是___________。
A.保持温度不变,增大甲容器的体积至2L
B.保持容器体积不变,使甲容器降低温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
3C(g)+2D(g);△H<0;4min后甲容器内的反应达到平衡,A的浓度为2.4mol·L-1,B的浓度为1.8mol·L-1;t min后乙容器内的反应达到平衡,B的浓度为0.8mol·L-1。根据题给的信息回答下列问题:
⑴甲容器中反应的平均速率υ(B)=_______________,化学方程式中计量数b=______。
⑵乙容器中反应达到平衡所需时间t___________4min(填“>”、“<”或“=”),原因是______________________________________________________。
⑶T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8mol·L-1,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是__________________、_____________________。
⑷若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是___________。
A.保持温度不变,增大甲容器的体积至2L
B.保持容器体积不变,使甲容器降低温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
20. (16分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
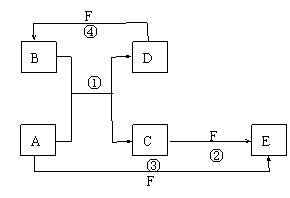
 ⑴若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色
气体生成,则A的原子结构示意图为_________________________________,
反应④的化学方程式为_____________________________________________________。
⑵若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是__________________________________________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式_______________________________________________________________________。
⑶若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为______________________________________________,B固体属于___________晶体。
⑴若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色
气体生成,则A的原子结构示意图为_________________________________,
反应④的化学方程式为_____________________________________________________。
⑵若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是__________________________________________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式_______________________________________________________________________。
⑶若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为______________________________________________,B固体属于___________晶体。
19. (9分) 某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应产物之一。 ⑴该反应中的还原剂是_____________________; ⑵该反应中的还原产物是___________________; ⑶写出该反应的化学方程式并标出电子转移的方向和数目: ______________________________________________________________________; ⑷若反应过程中转移了0.3mol电子,则生成水的质量是_______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com