
19.Ⅰ(4分)下列有关实验说法正确的是___________
A.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
B.除去铝器皿表面的碳酸钙而不损伤铝器皿,可用冷的浓硫酸。
C.水中含有少量苯和硝基苯,可用活性碳吸附除去
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
E.检验某溶液中含SO42-的操作与现象是:取试样少量,滴加氯化钡溶液有白色
沉淀,再加入盐酸,沉淀不消失,可确证其中含有SO42-
F.准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定
管,先用溴的四氯化
碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处。
Ⅱ(8分)氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪一种粒子(H2O,H+,SO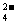 )能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
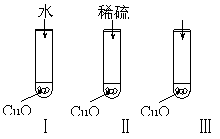
①你提出的假设是 ;
②通过实验Ⅰ可以证明 ;
③要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,
在Ⅲ中应加入 ;
④探究结果为 。
你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
18. 500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟时,分离出0.1mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
第二卷(非选择题,共78分)
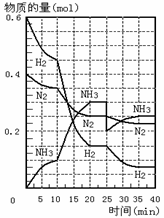
17.常温下,0.1 mol·L-1某一元酸(HA)溶液中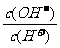 =1×10-8,下列叙述正
=1×10-8,下列叙述正
确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,
则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
c(A-) + c(HA) = c(Na+)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
2c(H+)+ c(HA) = c(A-) + 2c(OH-)
16.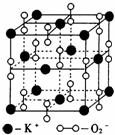 高温下,超氧化钾(KO2)晶体结构与NaCl相似,其晶体结构的一个基本重复单元如右图所示,已知晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法正确的是
高温下,超氧化钾(KO2)晶体结构与NaCl相似,其晶体结构的一个基本重复单元如右图所示,已知晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法正确的是
A.晶体中与每个K+距离最近的K+有12个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.超氧化钾晶体中阳离子与阴离子的个数比为1:2
D.晶体中,0价氧原子与-2价氧原子的数目比为1:1
15. 锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( 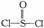 )中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,
)中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,
下列叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
14、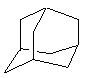 金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如右
金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如右
图所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是
A、4种 B、6种 C、8种 D、10种
13.蛇纹石由MgO、A12O3、Si02、Fe203组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是Si02
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加入过量的NaOH溶液,过滤,得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
12.硝苯地平缓释片(Nifedipine Sustained Release Tablets)用于治疗各种类型的高血压及心绞痛,其结构式如右图所示:
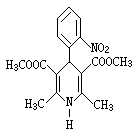 下列关于硝苯地平缓释片的说法正确的是
下列关于硝苯地平缓释片的说法正确的是
A.硝苯地平缓释片的分子式为C17H17N2O6
B.1mol硝苯地平缓释片在水溶液中最多能消耗4molNaOH
C.1mol硝苯地平缓释片在一定条件下能和5molH2发生加成反应
D.硝苯地平缓释片中N的化合价为-3
11.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述中,正确的是
A .H2Y在电离时为:H2Y+H2O HY-+H3O+
HY-+H3O+
B .在NaHY的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.在Na2Y的溶液中,离子浓度为:c(Na+)>c(Y2-) >c(OH-)>c(HY-)>c(H+)
D. HY-的水解方程式为:HY-+ H2O H3O++Y2-
H3O++Y2-
10.500mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com