
2.某溶液中含有HCO3-、CO32-、SO32-、Na+、五种离子。若向其中加入Na2O2粉末
充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是 ( )
A.NO3- B.CO32-、NO3- C.SO32-、NO3- D.CO32-、NO3-、Na+
1.保护环境是公民的责任和义务。下列说法正确的是 ( )
A.大量使用含磷洗涤剂会带来白色污染
B.减少使用氟氯代烷的目的是为了减少酸雨
C.大量开采地下水,以满足社会对水的需求
D.北京城区限制冬季燃煤供暖,是因为燃烧煤会有二氧化硫产生
26.(10分)自然界存在着一种白云石的矿石,其化学式是 xCaCO3·yMgCO3.以它为原料,可制取耐火材料等。(下面所涉及的气体体积均在标准状况下测定)
(1)称取27.6g白云石,加热到质量不再变化,试计算生成耐火材料MgO的物质的量(用x 、y的代表式表示)。
(2)若在上述反应中,收集到CO2体积6.72L,试写出白云石的化学式(取x、y的最小正整数比)。
(3)若把收集到6.72mL CO2用来制取化肥,即将CO2通入200mL2.25mol/L氨水中,充分反应后,试确定溶液中CO32-和HCO3-的物质的量之比(不考虑离子的水解)。
(4)若称取白云石m g,研碎后与过量炭粉混合,放在特定仪器中隔离空气强热一段时间后,测得白云石分解率为a,生成V L一氧化碳。试计算一氧化碳的体积V (用m、a代数式表示) 。(已知 CaO+3C  CaC2
+CO;2MgO+5C
CaC2
+CO;2MgO+5C Mg2C3+2CO)
Mg2C3+2CO)
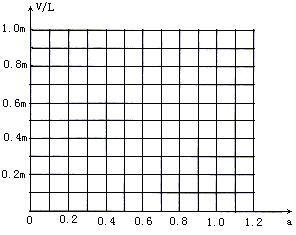
请在下图中画出V和a的关系图。
25.(6分)向Cu与CuO的混合物中加入混酸(硝酸和硫酸)后加热,使之恰好完全反应(设反应中不产生SO2和Cu(NO3)2),硝酸的还原产物只有NO,且得到NO8.96L(标准状况)。将溶液冷却后刚好全部结晶(无其它任何残留物),得到CuSO4·5H2O 250g。
求:⑴混酸中硝酸和硫酸的物质的量之比。
⑵原混合物中Cu和CuO的物质的量之比。
⑶混酸中硫酸的质量分数。
25.(8分) 从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题。
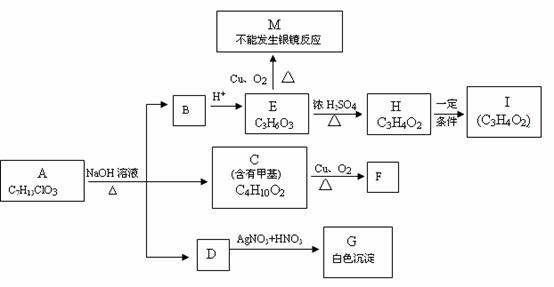
(1)写出下列物质可能的结构简式:
B ; M ;

 (2)指出反应类型: D G
E H
(2)指出反应类型: D G
E H
(3)写出下列反应的化学方程式:
 C F
C F
 H
I
H
I
24.(10分)有机物A(C8H8O2)为一种无色液体。从A出发可发生如下一系列反应
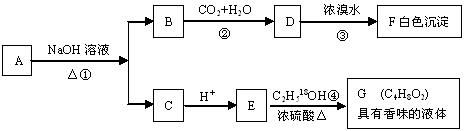
请回答:
(1)A和F的结构简式:A , F 。
(2)反应②的离子反应方程式: 。
反应④的化学反应方程式: 。(请注明示踪18O原子)
(3)A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有多种。写出其结构简式_____________________________________________ _____________________________________________________________________
23.(8分)A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属。其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物为X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。回答下列问题:
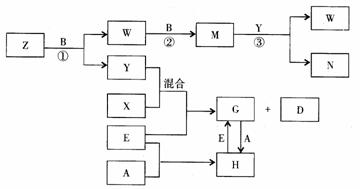
⑴ A的化学式为_______________;
⑵ 写出反应③的化学反应方程式_________________________________;
⑶ Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为__________________________;
⑷ 将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×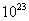 ,则参加反应的E的质量为________g;
,则参加反应的E的质量为________g;
⑸ 将Z与N反应后的产物溶于水中,则常温该溶液的pH_____7,其原因是(用离子方程式表示)___________________________________________。
22.(8分)在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2 及固体催化剂,使之发生反应: 2SO2(g) + O2 (g) 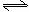 2SO3 (g) △H=-196.6kJ/mol
2SO3 (g) △H=-196.6kJ/mol
平衡时容器内气体压强为起始时的90%。此时
Ⅰ、加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 。
Ⅱ、保持同一反应温度,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g),欲使平衡时SO3的体积分数为2/9
①达到平衡时,Ⅰ与Ⅱ放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者 D.前者小于或等于后者
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示) 、 。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 。
21.(8分)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,
1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研
究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
 反应Ⅰ HgS
+O2 Hg +SO2
反应Ⅰ HgS
+O2 Hg +SO2
 反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
请试完成下列空白:
①HgS与氧气反应,氧化剂是 。
②请标出反应Ⅱ中电子转移的方向和数目。
③得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式: 。
④已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg + Hg2+  Hg22+ ,提
Hg22+ ,提
高Hg22+浓度的方法是: 。
20.(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-==I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-==S4O62-+3I-。
准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是
②实验中加入稀硫酸,你认为硫酸的作用是
③本实验中用碘量瓶而不用普通锥形瓶是因为:
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com