
8.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和乙烷的混合气体中含有的碳原子数约为3×6.02×1023
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.标况下,a L甲烷和乙烷混合气体中的分子数约为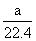 ×6.02×1023
×6.02×1023
7.运用元素周期律分析下面的推断。其中错误的是
A.已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
B.已知As是第四周期、VA族的元素,故AsH3的稳定性比NH3的稳定性强
C.已知Cs的原子半径比Na的大,故Cs与水反应比Na与水反应更剧烈
D.已知Cl的核电荷数比Al的核电荷数大,故 Cl的原子半径比Al的原子半径小
6.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同温度、同密度的C2H4和C3H6
D.同压强、同体积的N2O和CO2
5. 下列电子式书写错误的是

4.下列叙述正确的是
A.NH3是极性分子,N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央
3.下列变化不属于化学变化的是:
A.石油的分馏 B.白磷在一定条件下转化为红磷
C.NaCl溶液导电时发生的变化 D.Na2CO3•10H2O在干燥的空气中风化
2.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
1.以下化学用语正确的是
A.乙烯的结构简式CH2CH2 B.乙酸的分子式C2H4O2
C.明矾的化学式KAlSO4•12H2O D.氯化氢的电子式H∶Cl
24.(5分)
已知Fe3+的氧化性大于Cu2+,据此性质,某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。用离子方程式表示其化学原理 。
某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00mL废液,向其中加入0.64g金属铜,金属铜全部溶解;另取50.00mL废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g。请回答以下问题:
(1)该厂生产的废液中所含金属离子有 ;
(2)该厂原来使用的FeCl3溶液的物质的量浓度 (反应前后溶液的体积变化忽略不计);
(3)若向500.00mL废液中加入足量的稀硝酸,在标准状况下生成NO气体4.48L,则原废液中各金属阳离子的物质的是浓度之比为 ;
(4)另取500.00mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围为 。
23.(7分)电解法制碱的原料是饱和食盐水,由于精盐中含有泥沙和Ca2+、Mg2+、Fe3+、
SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制精盐水的实验过
程下:
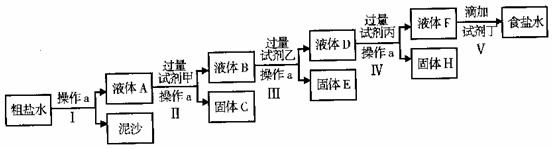 请回答以下问题:
请回答以下问题:
(1)操作a的名称是 ,所用玻璃仪器有 ;
(2)在II步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学
式 溶液;
(3)写出固体H所含物质的化学式 ;
(4)在V步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com