
19.(6分)在一定条件下,反应xA + yB  zC达到平衡:
zC达到平衡:
(1)若A、B、C 均为气体,则该反应的平衡常数表达式为____________________;
(2)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是______________________ ;
(3)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
(4)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为_态;
(5)加热后C的质量分数减少,则正反应是_________(填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变___________(填“大”或“小”)。
18. (9分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用左图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁:
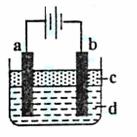
(1)a极材料为_____________ ,电极反应式为 _____________。
(2)电解液d可以是 ,则白色沉淀在电极上生成;电解液d也可以是 ,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是 ,在加苯之前对d溶液进行加热煮沸处理,目的是 。
(4)为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为 。
17.(A)(4分,错一个倒扣1分,扣完为止)
下列叙述中正确的是(填入序号)
① 已烷中混有已烯,加入足量的溴水,充分振荡,静置分层后分离
② 配制硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
(B)(12分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点? 。(2)碱式滴定管用蒸馏水洗涤后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度<计算出结果到小数点后二位)
mol·L-1。
16.物质的量浓度相同的下列溶液中,按pH由小到大的顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.NaHCO3 Na2CO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
第Ⅱ卷(非选择题共54分)
15.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是
A.硫酸铜的溶解度 B.溶液中溶质的质量分数
C.溶液的质量 D.溶液中Cu2+的数目
14.在一个固定容积的容器中,有可逆反应:
 (Ⅰ)2A(g)+B(g) 2C(g) ;ΔH=+Q1
kJ·mol-1
(Ⅰ)2A(g)+B(g) 2C(g) ;ΔH=+Q1
kJ·mol-1
 (Ⅱ)3A(g) D(g)+E(g) ;ΔH=-Q2
kJ·mol-1,下列条件均能使反应(Ⅰ)、(Ⅱ)中A的转化率增大的是:
(Ⅱ)3A(g) D(g)+E(g) ;ΔH=-Q2
kJ·mol-1,下列条件均能使反应(Ⅰ)、(Ⅱ)中A的转化率增大的是:
①增大压强 ②升高温度 ③增加A的浓度
A.仅① B.①③ C.①②③ D.都不能
13.下列离子方程式书写错误的是
A.FeCl2溶液中通入Cl2:2Fe2+ +Cl2=2Fe3+ + 2Cl-
B.AlCl3溶液中加入过量氨水:Al3+ + 4OH-=AlO2- + 2H2O
C.苯酚钠溶液中通入过量的二氧化碳:
 +CO2
+H2O →
+HCO3-
+CO2
+H2O →
+HCO3-
D.FeS固体放入稀硫酸溶液中:FeS + 2H+ =Fe2+ + H2S↑
12.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
11.常温时0.1 mol· L-1HA溶液的pH>1,0.1 mol·L-1BOH溶液中[OH-]∶[H+]=1012,将两溶液等体积混合,以下判断正确的是
A.[H+]< [OH-]< [B+] < [A-] B.[OH-]< [H+]< [B+]<[A-]
C.[H+]+ [B+]= [A-]+[OH-] D.[A-]= [B+]>[H+]= [OH-]
10.某温度下,1mol甲烷气体完全燃烧放出的热量为802kJ,但当不完全燃烧仅生成CO和H2O时,放出热量为QkJ。如果1mol甲烷与60g氧气完全作用生成CO、CO2和H2O时,能放出731.5kJ热量,则上述Q的数值 ( )
A.大于802 B.等于802
C.大于731.5 D.小于731.5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com