
8. 下图表示反应A(气)+B(气) nC(气);△H<0在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
nC(气);△H<0在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
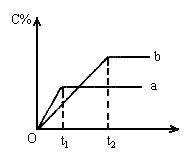
A. 若其它条件相同,a比b的温度
B. a表示有催化剂,b表示无催化剂
C. 若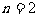 ,其它条件相同,a比b的压强大
,其它条件相同,a比b的压强大
D. 反应由逆反应开始 t
7. 航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程为: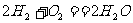 ,该电池的正极反应可表示为 ( )
,该电池的正极反应可表示为 ( )
A. 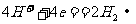 B.
B. 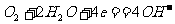
C. 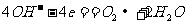 D.
D. 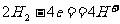
6. 下列离子方程式不正确的是 ( )
A. 向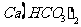 溶液中滴入少量NaOH溶液
溶液中滴入少量NaOH溶液
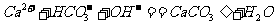
B. 等体积、等物质的量浓度的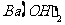 和
和 溶液混合
溶液混合
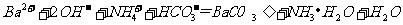
C. 向 溶液中通入过量
溶液中通入过量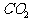
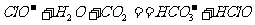
D. 向100 mL 1 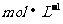 的
的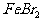 溶液中通入
溶液中通入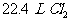 (标况下)
(标况下)
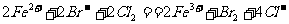
5.常温下分别将下列各组中的两种溶液等体积混合,所得溶液pH一定等于7的是
A、0.1mol/L的某一元酸和0.1mol/L的某一元碱
B、0.1mol/L的某二元强酸和0.1mol/L的某二元碱
C、pH=2的某一元酸和pH=12的某一元碱
D、pH=3的某二元强酸和pH=11的某一元强碱
4.下列事实不能用勒夏特列原理解释的是 ( )
A、开启啤酒瓶后,瓶中马上泛起大量泡沫
B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
C、实验室中常用排饱和食盐水的方法收集氯气
D、由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
3.下列各项中的“黄色”,不属于因化学反应而产生的现象的是 ( )
A.无色试剂瓶中的浓硝酸呈黄色B.在硫化钠溶液中加入双氧水后有黄色沉淀生成
C.食盐在无色的火焰上灼烧时,火焰呈黄色 D.久置的碘化钾溶液呈黄色
2.在由水电离产生的c(H+)=10-12mol·L-1的溶液中,一定能大量共存的离子组是( )
A、NH4+、Ba2+、Cl-、NO3- B、Cl-、SO42-、Na+、K+
C、SO42-、NO3-、Fe2+、Mg2+ D、Na+、K+、ClO-、I-
1、旨在限制全球温室气体排放量的《京都议定书》于2005年2月16日正式生效。为降低我国二氧化碳气体排放量(居世界第二)的下列措施中,你认为不切合实际的是 ( )
A、充分利用太阳能
B、合理、安全开发利用氢能、核能
C、因地制宜开发利用风能、水能、地热能、潮汐能
D、停止使用产生二氧化碳气体的化学能
20、向100 mL3 mol·L-1硫酸铝铵[NH4Al(S04)2]溶液中逐滴加入1 mol·L-1 Ba(OH)2溶液.
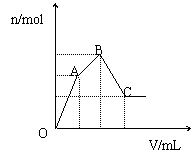

(1)写出当刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示): .
(2)随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.写出B点和C点所对应的Ba(OH)2溶液的体积:B ,C .
19.向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量。
⑴方案一是否可行 (填“是”或“否”),理由是 。
⑵假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)= mol,则说明溴水与乙醛发生取代反应;若测得反应后n(Br-)= mol,则说明溴水与乙醛发生加成反应;若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸。
⑶按物质的量之比为1:5配制1000mLKBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5molBr2。 取该溶液10mL加入足量乙醛溶液,使该溶液褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g。若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为 (选填猜想序号)。
⑷写出上述测定过程中的三个反应的离子方程式:
①KBrO3和KBr在酸性条件下的反应 : ;
②溴水与乙醛的反应: ;
③测定Br-离子含量的反应: ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com