
21.(7分)2000年美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的O4分子,专家认为它液化后的能量密度比普通氧分子高得多。O4分子的结构如下图所示,是平面型分子,键角为120°。四个氧原子以一个O原子为中心,与另外三个O原子分别构成一个非极性共价键;中间O原子提供三个电子,周围三个O原子各提供1个电子,构成一个特殊的化学键--四个O原子均等地享有这6个电子,请回答:
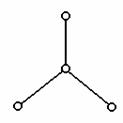
(1)O4固体属于____________晶体(填“原子”、“离子”、“分子”、“金属”)
(2)O4与氧气的关系是__________,它们之间的转化是否为氧化还原反应_________(填是或否)。
(3)O4具有强氧化性,能将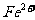 氧化为
氧化为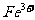 ,试配平:(提示:在相同温度和压强下,反应前后气体体积不变)
,试配平:(提示:在相同温度和压强下,反应前后气体体积不变)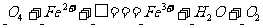
在该反应中,当生成1 molO2,转移电子的物质的量为________ mol。
22(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是____________,乙物质的电子式是____________·
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是____________(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是___________。
20.(13分)已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。
反应生成的水均已略去。它们有如下图所示的关系。
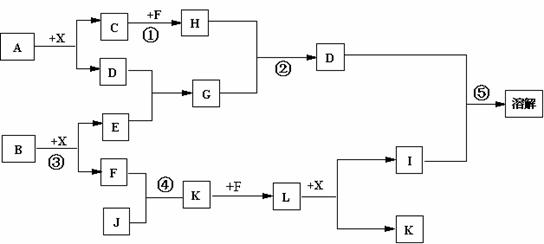
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)写出离子方程式分别为:反应② ;⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
19.(8分)试用离子方程式表示下列各变化
(1)将FeCl3饱和溶液滴入到沸水中 ;
(2)向(1)所得的混和物中逐滴加入盐酸: ;其现象是 。
(3)向FeCl3溶液中滴加KSCN溶液,溶液呈血红色;若向FeCl3溶液中先加入NaF,再加入KSCN则看不到溶液呈红色,其原因不可能是 (填序号,多选倒扣分)
A、Fe3+强氧化性将F-氧化
B、Fe3+与F-形成复杂的稳定的化合物
C、Fe3+与F-发生反应转化为Fe (OH)3沉淀
(4)若向FeCl3溶液中先加入足量的HCl,再加入NaF和KSCN,则仍能显血红色,其原因是 。
18.(11分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:第一步:连接好装置,检验气密性,在仪器内装入药品。第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。第三步:过滤C中所得的混合物,得到NaHCO3固体。第四步:向滤液中加入适量的NaCl粉末,有NH4C1晶体析出。……请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( ); (b)接( )
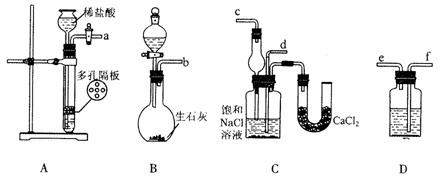
(2)A中常选用的固体反应物为 ;D中应选用的液体为 ;B中发生反应的化学方程式为 。
(3)第二步骤中必须先让 装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是 ,C中广口瓶内产生固体的总化学方程式为 。
(5)第四步中分离出NH4C1晶体的操作是 ;其所得的NH4C1晶体中常含有少量的NaCl和NaHCO3约占5%~8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:
17.(1)(4分)下列有关实验的叙述,不正确的是(填序号)
A、为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
B、用渗析法分离淀粉中混有的NaCl杂质
C、点燃可燃性气体时,都要先检验气体纯度,后点燃。
D、用酸式滴定管量取20.00mL高锰酸钾溶液
E、为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F、皮肤上沾有少量浓硫酸,可立即用大量水冲洗
G、足量Cl2通入FeCl2溶液后,将溶液蒸干并灼烧,可得到Fe2O3
H、用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
J、用结晶法可以除去硝酸钾中混有的少量氯化钠
(2)(5分)被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸酯产生能量,该能量被传递给荧光物质后便发出荧光.回答下列问题:
①有人说,发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸,是否正确?说明理由。 。
②通过挤压,使过氧化氢与草酸酯混合反应,导致魔棒发光,一段时间后,光的亮度降低,此时,把魔棒往手心上敲打几下,亮度会重新增大,原因是什么?(提示:草酸酯是一种有较高粘度的有机化合物) 。
③在设计魔棒时,其连续发光的能力在8-12h,如果在发光中途,把它放入冰箱的冷冻室中,发光便会停止或基本停止.把魔棒从冷冻室中取出静止一会儿,它又会连续发光,原因产什么?
16.将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
第Ⅱ卷 (非选择题共86分)
14. 在容积一定的密闭容器中,反应2A
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
在容积一定的密闭容器中,反应2A
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
A.正反应是吸热反应,且A不是气态
B.正反应是放热反应,且A是气态
C.其他条件不变,加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动无影响
15 已知反应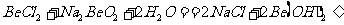 能完全进行,则下列推断中,正确的是
( )
能完全进行,则下列推断中,正确的是
( )
A. 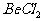 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B. 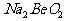 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C.  既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D. 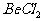 水溶液的导电性强,因此
水溶液的导电性强,因此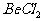 一定是离子化合物
一定是离子化合物
13.下列叙述中,正确的是( )
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素的化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
12..已知溶质的质量分数为95%酒精溶液的物质的量浓度为16.52 mol·L-1,试判断溶质质量分数为47.5%酒精溶液的物质的量浓度为 ( )
A.小于8.26 mol·L-1 B.等于8.26 mol·L-1
C.大于8.26 mol·L-1 D.无法判断
9.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A、1mol金刚石晶体中含碳碳键数为2 NA
B、常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C、标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D、1molNa2O2与足量CO2反应转移的电子数NA
10有乙离子存在时,欲用试剂丙来检验溶液中是否含有甲离子,在只有试管和滴管情况下,下表所加试剂丙能够对甲离子进行成功检验的是
|
选 项 |
试 剂 丙 |
甲离子 |
乙离子 |
|
A |
稀盐酸酸化的Ba(NO3)2溶液 |
SO42- |
SO32- |
|
B |
AgNO3溶液 |
Cl- |
I- |
|
C |
KSCN溶液 |
Fe2+ |
Fe3+ |
|
D |
稀氨水 |
Al3+ |
Ag+ |
11下列有关物质性质的比较正确的是
A、元素的最高正化合价在数值上等于它所在的族序数
B、同周期主族元素的原子半径越小,越难失去电子
C、还原性:S2->Se2->Br->Cl-
D酸性:HClO4>H2SO4>H3PO4>H2SiO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com