
3.每个公民都应该有安全意识,今年频繁发生的有关化学品泄漏或爆炸事件一次又一次给我们敲响了警钟。下列做法存在安全隐患的是
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;②给试管中液体加热时,应将试管倾斜,与桌面成45°角,再集中在药品处加热;③取用金属Na或K时,用剩的药品要放回原瓶;④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风;⑤在做苯酚性质实验时,因为常温时苯酚在水中溶解度较小,所以可以将废液直接通过水池排入下水道;⑥废旧电池应回收处理。
A.全部 B.①②④⑤ C.①③⑤ D.①④
2.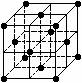 晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示,下列说法正确的是
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示,下列说法正确的是
A.C60摩尔质量是720
B.C60与棒碳互为同素异形体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300-500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。根据以上叙述回答1、2两小题:
1.对于C60与棒碳,下列说法正确的是
A.C60在一定条件下可能与CuO发生置换反应
B.棒碳不能使溴水褪色
C.C60与棒碳中所有的化学键都是非极性共价键
D.棒碳与乙炔互为同系物
25、(11分)在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g) 3C(g)+2D(s);ΔH<0。达到平衡时生成了1.8 mol
C。
3C(g)+2D(s);ΔH<0。达到平衡时生成了1.8 mol
C。
⑴在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
⑵若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D) mol。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生重大影响。
⑶若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:
;此时A、B、C、D四种物质相对分子质量之间的关系为 (用Mr(A)、Mr(B)、Mr(C)、Mr(D)表示)。
⑷若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时: 。
24.(8分)在室温下,向200 mL Cu(IO3)2饱和溶液(密度为1.0 g/cm3)中加入足量的经酸化的KI溶液,发生如下的反应:5I- + IO3- + 6H+ = 3I2 + 3H2O ,2Cu2+ + 4I- = 2CuI + I2 。反应后,用0.22 mol/L Na2S2O3溶液滴定(I2 + 2S2O32- = 2I- + S4O62-),消耗了35.30 mL Na2S2O3溶液。计算原饱和溶液中Cu(IO3)2的物质的量浓度以及质量分数分别是多少?
23、(10分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。
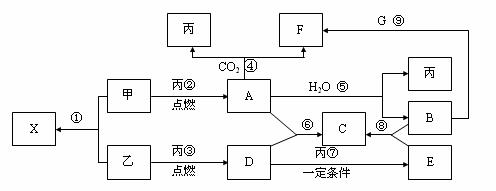
请回答:
(1) 写化学式:丙_________,E________。
(2)X的电子式为____________________。
(3) 写出A与H2O反应的化学反应方程式:__________________________ 。
(4) 写出B与G溶液反应生成F的离子方程式:________________________。
(5) 在上图的反应中,不属于氧化还原反应的是(填序号)______________。
22、 (8分)在含有n molFeI2的溶液中通人Cl2,有xmolCl2发生反应。
(8分)在含有n molFeI2的溶液中通人Cl2,有xmolCl2发生反应。
(1)当x≤ 时,反应的离子方程式为 。
(2)当反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-时,x与n的关系为 。
(3)当Fe2+和I-同时被氧化时,x与n的关系为 。
(4)当x=n时,反应后氧化产物的物质的量为 mol。
21、(8分)化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)许多化学反应的反应热可以直接测量,其测量的仪器叫做__________
(2)下列△H表示物质燃烧热的是___________(4、5)表示物质中和热的是________( 用△H1 、△H2 、 △H3等回答)
A. 2H2(g)+O2(g)=2H2O(l) ;△H1
B.C(s)+1/2O2(g)=CO(g);△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ;△H3
D.C(s)+O2(g)=CO2(g);△H4
E.C6H12O6(s)+12O2(g)=6CO2 (g)+6H2O (l) ;△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ;△H6
G.NaOH(aq)+H2SO4 (aq)=Na2SO4(aq) + 2H2O(l) ;△H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ;△H8
(3)2.00g C2H2气体完全燃烧生成液态水和CO2,放出99.6 kJ的热量.写出该反应的热化学方程式:____ ________.
(4)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与5 mol·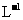 100 mL KOH溶液完全反应.求燃烧1 mol丁烷放出的热量(设其数值为X)___
_ .
100 mL KOH溶液完全反应.求燃烧1 mol丁烷放出的热量(设其数值为X)___
_ .
20.(10分)称取三份锌粉,分盛在三只锥形瓶中,按下列要求另加物质后,塞上带导管的塞子,测定生成H2的体积。锥形瓶甲中加入pH=2的盐酸10mL,乙中加入pH=2的醋酸10mL,丙中加入pH=2的醋酸10mL及少量CuSO4粉末。若反应终了,生成H2体积相同,且锌没有剩余。请在小题⑴、⑵、⑶中用>、=或<回答:
⑴开始时反应速率υ的大小关系为 。
⑵三只锥形瓶中参加反应的锌的质量m大小关系为 。
⑶在反应停止后,甲、乙溶液中c(Cl-) c(CH3COO-)、c(OH-)甲 c(OH-)乙
⑷简要说明在反应过程中乙、丙中反应的速率不同的理由是 。
⑸若开始时,在甲乙锥形瓶中分别加水稀释至100mL,此时乙锥形瓶中溶液的pH范围是
。
|
a |
|
|
|
|
|
|
b |
|
|
|
|
d |
e |
f |
|
|
|
c |
|
|
g |
|
|
h |
|
19.(11分)右表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素:
⑴ 其中_________元素(填字
母)可以形成硬度最大的单质。
⑵ “神舟”五号飞船内需要有一种化合物来吸收宇航员呼出的 CO2,你认为该物质应该是由上表中的________和_______元素(填字母)组成的。飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入一种气体用于稀释氧气,该气体分子的电子式是__________。
⑶ 在一定条件下,a与 h可形成一种化合物,当固态时,其晶体类型为_______________;该物质溶于水后的溶液呈 ________ 性(填“酸”、“碱”或“中”)。
⑷ 现有另一种元素X,其原子获得一个电子时所放出的能量比上表中所列元素中都要大,则 X 是 __________ 元素(填名称),其在周期表中位于_____ 族。
(5)含f元素且f质量分数最高的化合物的电子式是 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com