
13.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-) 在其间 通过,该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
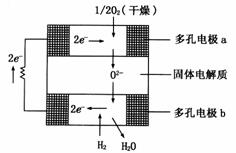
A.有O2参加反应的a极为电池的负极
B.b极的电极反应为:H2 - 2e- + O2- = H2O
C.a极的电极反应为:O2 + 2H2O + 4e- = 4OH-
D.电池的总反应式为:2H2 + O2
 2H2O
2H2O
12.据最新报道,科学家发现了如下反应:O2 + PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子
D.在O2(PtF6)中不存在共价键
11.利用右图进行实验,下列实验结果能说明结论的是
A.甲:盐酸,乙:石灰石,丙:苯酚钠溶液。
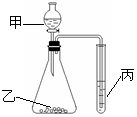 证明酸性:盐酸>H2CO3>C6H5OH
证明酸性:盐酸>H2CO3>C6H5OH
B.甲:盐酸,乙:硫化亚铁,丙:溴水。
证明还原性:S2->Br->Cl-
C.甲:水,乙:电石,丙:溴水。
证明稳定性:H2O>C2H2>Br2
D.甲:浓盐酸,乙:高锰酸钾,丙:溴化钾溶液。
证明氧化性:KMnO4>Cl2>Br2
10.下列各组离子,在指定的环境中一定能大量共存的是
A.在pH为7的溶液中:Ag+、K+、SO42-、Cl-
B.在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-、
D.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
9.NA代表阿伏加德罗常数的值,下列说法正确的是
A.1 mol HNO3见光分解,转移电子数4NA
B.28 g晶体硅中含有Si-Si键的数目为2NA
C.100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+
D.Cu与浓硝酸产生的22.4 L(标准状况)气体中含原子数为3NA
8.恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-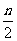 )
)
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.当v正(A)=2v逆(B)时,可确定反应达平衡
7.在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与BaCl2溶液的体积比是
A.10∶1 B.1∶10 C.9∶1 D. 1∶9
6.下列混合物的分离或提纯操作中不正确的是
A.除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B.除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法
C.除去乙醇中的少量NaCl,可用蒸馏的方法
D.重结晶、滴定操作都可用于提纯物质
5.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸 B.漂白剂 C.还原剂 D.氧化剂
4.关于某溶液所含离子检验的方法和结论正确的是
A.加入过量NaOH溶液,有白色沉淀生成,则原溶液一定有Mg2+
B.加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液一定有Cl-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中可能有CO32-或SO32-
D.加入NaOH并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液是铵盐溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com