
17.常温下,0.1 mol·L-1某一元酸(HA)溶液中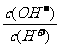 =1×10-8,下列叙述正确的是(
)
=1×10-8,下列叙述正确的是(
)
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,
则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
c(A-) + c(HA) = c(Na+)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
2c(H+)+ c(HA) = c(A-) + 2c(OH-)
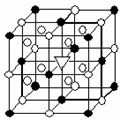
16.冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为
 Na3AlF6 =3Na+
+ AlF6-
Na3AlF6 =3Na+
+ AlF6-
●位于大立方体顶点和面心
○位于大立方体的12条棱的中点和8个小立方体的体心
那么大立方体的体心处▽所代表的微粒是 ( )
A .Al3+ B.Na+ C.F- D.AlF6-
15. 锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( 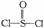 )中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
( )
)中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
14.现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( )
A.一定呈酸性 B.可能呈碱性 C.可能呈中性 D.一定呈中性
13.蛇纹石由MgO、A12O3、Si02、Fe203组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是Si02
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加入过量的NaOH溶液,过滤,得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
12.前不久在央视爆光的用苏丹红Ⅳ号饲养鸭子生红心鸭蛋的报道让人触目惊心。苏丹红有Ⅰ、Ⅱ、Ⅲ、Ⅳ号四种,均具有致突变性和致癌性。 “苏丹红Ⅳ号”与“苏丹红Ⅰ号”主体结构相同,但存在差别,均有致癌作用,它们的结构如下:则下列有关苏丹红有Ⅰ号和苏丹红Ⅳ号的叙述正确的是 ( )
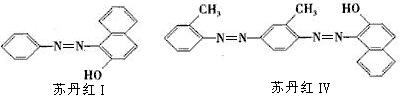
A.苏丹红Ⅰ号和苏丹红Ⅳ号都是有毒物质,两者互为同系物。
B.它们均能与NaOH溶液、FeCl3溶液、溴水等物质反应。
C.它们分子中的所有原子都可能在同一平面上。
D.苏丹红Ⅰ号和苏丹红Ⅳ号均属于芳香族化合物,分子式分别为C16H12N2O、C24H20N4O
11.下列各组离子在所给条件下能大量共存的是 ( )
A.在滴加酚酞试液呈红色的溶液中: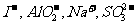
B.在pH=0的溶液中: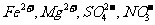
C.由水电离出的c(H+)=1×10-12mol/L的溶液中: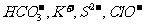
D.加入单质硅能产生H2的溶液中:
10.500mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是 ( )
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
9.恒温下的下列实验过程中,有关溶液的浓度和质量始终不变的是 ( )
A.向浓氨水中持续通入干燥洁净的空气(不含CO2)
B.向KNO3饱和溶液中加入ngKNO3晶体
C.向98.3%浓H2SO4中加入ngSO3
D.向CuSO4饱和溶液中加入ng无水CuSO4
8.本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学反应速率理论是研究怎样提高原料转化率
C.化学平衡理论是研究怎样使用有限原料多出产品
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com