
2.下列关于某些社会热点问题的说法中,不正确的是
A.光化学烟雾的产生与碳氢化合物、氮氧化物的排放有关
B.禁止使用含铅汽油是为了提高汽油的燃烧效率
C.臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关
D.甲醛是某些劣质装饰板材释放的常见污染物之一
1.碱金属与卤素所形成的化合物大都具有的性质是:①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电
A.①②③ B.③④⑤ C.①④⑤ D.②③⑤
28.(11分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
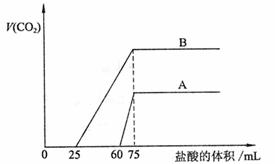
(1) 曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式): ,各种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式): ,各种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
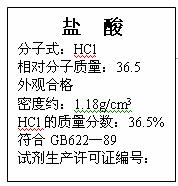
27.(8分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取该盐酸25.4mL与2.00mol/L的氢氧化钠溶液100mL混合,再将混合后溶液稀释至1.00L,此时溶液的pH约为多少?
26、(12分) 下图为一些常见物质的转化关系图。已知:①电解C溶液的反应是无机化工生产中的一种重要反应,②Q、M为常见单质 ③F、L是含有同一种元素的化合物,该元素在两种化合物中的化合价不同。
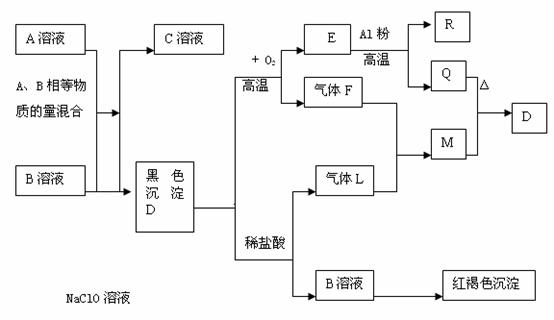
试回答下列问题:
(1)B、D的化学式为:B D
(2)完成下列反应的化学方程式:
① F + L → M + H2O
②电解C的饱和溶液
(3)①A溶液与B溶液反应的离子方程式
②R与NaOH溶液反应的离子方程式
25、(10分)已知2SO2(g)+O2(g)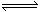 2SO3(g);△H=-a kJ/mol(a>0)。在一个有催化剂存在的固定体积的容器中充入2mol SO2和1mol O2,在500℃时充分反应达到平衡时,SO3的浓度为W mol/L,放出热量为b kJ。
2SO3(g);△H=-a kJ/mol(a>0)。在一个有催化剂存在的固定体积的容器中充入2mol SO2和1mol O2,在500℃时充分反应达到平衡时,SO3的浓度为W mol/L,放出热量为b kJ。
(1)比较a、b大小 a b。
(2)若在原来的容器中只加入2mol SO3,500℃时充分反应达到平衡时,SO3的浓度为 mol/L,吸收热量c kJ,则a、b、c三数值满足何种关系 。
(3)若将上述容器改为恒压容器(反应前体积相同)充入2molSO2和1molO2,
在500℃时充分反应达到平衡时,放出热量为d kJ。请比较d、b大小 d b。
(4)若将上述容器改为恒压容器(反应前体积相同)充入2mol SO3,500℃时充分反应达到平衡时,SO3的吸收热量为e kJ。请比较e、c大小 e c。
23.
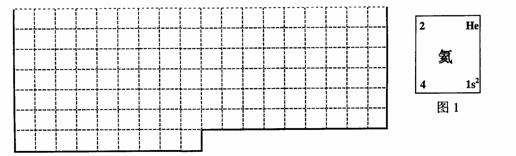
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
 (2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________
甲、乙的最高价氧化物水化物的酸性强弱为:__________>__________(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:
__________________________________________________________________________
24、(12分)
23、(15分)实验室常用的几种气发生装置如图4-3所示:
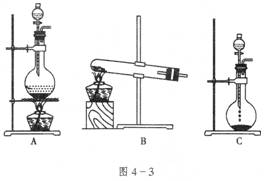
(1)实验室利用氧化钙和浓氨水制取氨气,应选装置____________;控制氨气生成的操作为: ______。
(2)现有两种方法制取氧气,可供选用的药品有: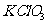 、
、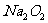 、
、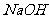 、
、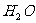 、
、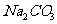 、
、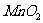 。
。
第一种方法是选择装置B,则需选用的试剂为______________;
第二种方法是选择装置C,则需选用的试剂为______________。
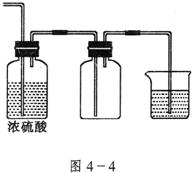
(3)若把A装置与图4-4装置相连,在实验室可用来制取下列气体中的_______________(填序号)。①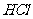 ②
②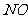 ③
③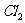
制取这种气体时,除选用(2)所供几种药品外,还需要的一种试剂是_____________。
图4-4小烧杯中盛的试剂是_____________。其作用是_____________________。
22、(8分)(1)现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,
其正确的操作是_______________________________________________________________
纯碱溶液呈碱性的原因(用离子方程式表示)是___________________________,你认为该溶液的pH的范围一定介于____________之间。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com