
5. 食品中含有过量的 (丙烯酰胺)可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:①能使酸性高锰酸钾溶液褪色,②能发生加聚反应,③能与氢气发生加成反应, ④是高分子化合物。其中正确的是
A.①②④ B.②③④ C.①②③ D.①③④
4.
金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关 和
和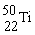 的说法中正确的是
的说法中正确的是
A.
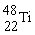 和
和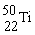 原子中均含有22个中子
原子中均含有22个中子
B.
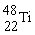 和
和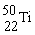 在周期表中位置相同,都在第4纵行
在周期表中位置相同,都在第4纵行
C.
分别由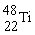 和
和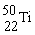 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
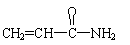 D.
D.
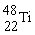 与
与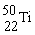 为同一核素
为同一核素
3.巴豆酸的结构简式为CH3CH=CHCOOH ,现有
①水 ②溴的四氯化碳溶液 ③丁醇
④纯碱溶液 ⑤酸性KMnO4溶液。
在一定条件下,能与巴豆酸反应的物质组合是
A.只有②④⑤ B.只有②③⑤
C.只有②③④⑤ D.①②③④⑤
2. NA为阿伏加德罗常数,下列说法中正确的是
A.用稀氢氧化钠溶液吸收氯气22.4L,反应中转移的电子数目为NA
B. 1mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA
C. 室温下,28.0g乙烯和丙烯混合气体中含有的碳原子数为2NA
D. 标准状况下11.2L臭氧中含有的氧原子数目为3NA
1.下列叙述不正确的是
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性
D.太阳能电池可用硅材料制作,其应用有利于环保、节能
27.(10分)某有机物A的结构简式为:
⑴某同学对其可能具有的化学性质进行了如下预测,其中错误的是 。
①可以使酸性高锰酸钾溶液褪色;
②可以和NaOH溶液反应;
③在一定条件下可以和乙酸发生反应;
④在一定条件下可以发生消去反应;
⑤在一定条件下可以和新制Cu(OH)2反应;
⑥遇FeCl3溶液可以发生显色反应。
⑵该有机物的同分异构体甚多,其中有一类可以用 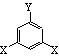 通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
, , , 。
26.(12分)法国化学家V.Grignard,所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成。Grignard试剂的合成方法是:RX+Mg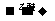 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种。
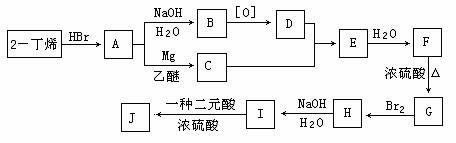
请按要求填空:
⑴F的结构简式是 ;
⑵C+D→E的反应类型是 ,F→G的反应类型是 ;
⑶写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
 ⑷I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式
。
⑷I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式
。
25.(13分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
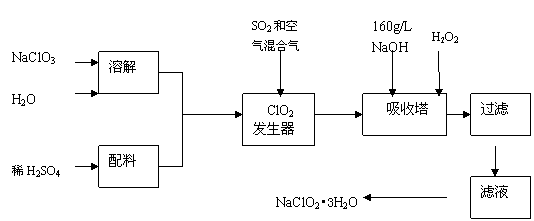

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
⑴160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
⑵发生器中鼓入空气的作用可能是 (选填序号)。
(a)将SO2氧化成SO3,增强酸性;(b)稀释ClO2以防止爆炸;(c)将NaClO3氧化成ClO2
⑶吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:
。
⑷在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是
否过量的简单实验方法是 。
⑸吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
(a) Na2O2 (b) Na2S (c)FeCl2 (d)PbO(悬浊液)
⑹从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
24.(8分)下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
|
|
|
|
||||||
|
a |
|
|
|
b |
c |
d |
e |
|
|
f |
|
g |
|
|
h |
|
|
⑴g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。

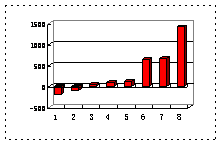
⑵第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序号“2”代表 ,“8”代表 。
⑶a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序号“5”氢化物的化学式为 ,序号“1”的氢化物的电子式: 。
⑷电子排布式为[Ne] 3S23P4的元素名称为: ;其氢化物的空间构型为: 。
23.(7分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
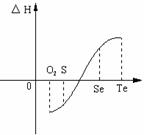
⑴碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
⑵等物质的量氧气、硫、硒、碲与H2反应的焓变。情况如图所示:
请回答下列问题:
⑴H2与硫化合的反应 热量(填“放出”或“吸收”)。
⑵已知H2Te分解反应为熵增反应,请解释为什么Te和H2的反应不能自发发生 。
⑶在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为 (用含α甲的代数式表示),此时α甲 α乙(填“大于”、“小于”或“等于”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com