
3.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.60.0g二氧化硅晶体中,含有“Si-O”键的数目为NA
B.34g过氧化氢分子中极性共价键的数目为NA
C.标准状况下,22.4L甲烷和氨气的混合气体所含有的电子总数约为10NA
D.1molT2气体分子(超重氢分子)中所含的中子总数为2NA
2.根据下表中列出的数据,判断下列热化学方程式书写不正确的是
|
化 学 键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1mol化学键时放出的能量 |
436kJ·mol-1 |
243kJ·mol-1 |
431kJ·mol-1 |
A.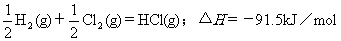
B.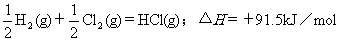
C.
D.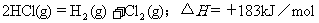
1.下列各原子或离子的电子排布式错误的是
A.Si 1s22s22p2 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Al 1s22s22p63s23p1
26、(9分)氧化铜在高温下发生分解反应:4CuO 高温 2Cu2O+O2↑,把一定量的氧化铜粉末在高温下加热使其部分分解,得到固体混合物(CuO、Cu2O),铜和氧的质量比用mCu:mO表示,请回答下列问题。
(1)上述固体混合物中mCu:mO不可能是:________(选填A、B、C,多选扣分)
A.16:2 B.16:3 C.16:4
(2)若所得的固体混合物中mCu:mO=16:a,计算CuO的分解率A%= %。
(3)如果CuO被H2还原分两步进行
|
|
2CuO+H2======Cu2O+H2O Cu2O+H2======2Cu+H2O
试分析反应后得到的固体混合物的可能组成,相应的mCu:mO=16:b,写出b的取值范围,将结果填入下表(不一定填满)。
|
混合物组成(用化学式表示) |
b的取值范围 |
|
|
|
|
|
|
|
|
|
|
|
|
25、(7分)标准状况下乙烷和某烃的混合气体1.344L,与足量氧气混合点燃爆炸后,将所得气体通入300mL 0.400mol/LNaOH溶液中,使逸出的气体不含CO2,把吸收CO2后的溶液在减压条件下蒸干得固体7.60g(不含结晶水),求原混合气体的具体组成。
24、我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为:
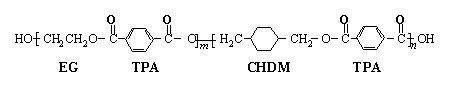
已知:
(1)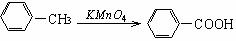
(2)RCOOR1 +R2OH RCOOR2 +R1OH (R、R1、R2表示烃基)
RCOOR2 +R1OH (R、R1、R2表示烃基)
这种材料可采用以下合成路线:
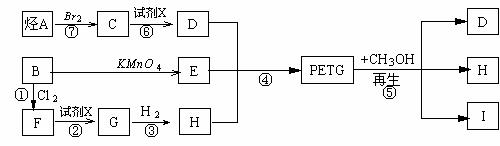
试回答下列问题:
(1)反应②⑥加入的试剂X是______________________
(2)⑤的反应类型是______________________
(3)写出结构简式:B____________________I____________________
(4)合成时应控制的单体的物质的量
n(D)∶n(E)∶n(H)= _____∶______∶______(用m、n表示)
(5)写出化学方程式:
反应③: 反应⑥:
23.(13分)工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
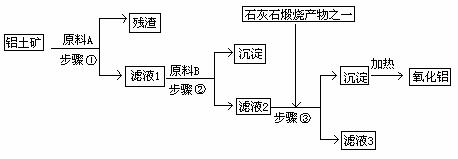
(1)原料A的名称是_____________,步骤①反应的离子方程式是_________________。
(2)滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:______________。
(3)步骤③的化学方程式是:________。
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响
______________________________________。
22.(9分)短周期的四种元素X、Y、Z、W,原子系数依次增大,Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,其中化合物C在空气中容易变白,请回答:
(1)写出Z的原子结构示意图_____________________________________________。
(2)写出化合物YZ2电子式:______________________________________________,
写出化合物C的电子式:______________________________________________。
(3)写出化合物C在空气中变白的化学方程式:_______________________________
20.(7分)为了测定某烷样品(丁烷,并含少量丙烷等气态烃)的平均相对分子质量,设计了下面的实验:
1取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量得到质量m1。
2往锥形瓶中通入干燥的该烷烃样品,塞好胶塞,准确称量;重复操作,直到前后2次称量结果基本相同,得到质量m2。
3往锥形瓶内加满水,塞好胶塞,称量得到质量m3。已知实验时的温度为T(k),压强p(kPa),水的密度ρ水(g/L),空气平均相对分子质量29.0,空气的密度ρ空气(g/L),回答下列问题:
(1)本实验的理论依据是(具体说明)__________________________________________
___________________________________________________________________________。
(2)步骤2中为什么要重复操作,直到后2次称量结果基本相同?答:______________
___________________________________________________________________________。
(3)具体说明本实验中怎样做到每次测量都是在相同体积下进行的?答:____________
(4)本实验收集气体样品的操作,可选用的方法是(填图中标号)__________。

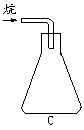


(5)锥形瓶内空气的质量m空气是_______________________________________。
(6)瓶中样品的质量m样品是___________________________________________。
(7)由实验测得该烷烃的平均相对分子质量是______________________________。
[(5)(6)(7)三空均列出算式]
19.(6分)“过氧乙酸”是抗“非典”中广泛用于医院、地面、门窗、汽车等方面的消毒液。下面是市售过氧乙酸商品标签:
|
过氧乙酸 甲、乙溶液各500mL 用法:把本品甲溶液1份,乙溶液 1份在玻璃或塑料容器内混合放24 小时,即可稀释使用 |
技术要求 含量不少于10%,一般可以用50倍纯水稀释使用(浓度为0.2%) |
(1)配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?某校研究性学习小组为此进行以下研究,请你完成下列相关内容:
1查阅资料:过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH)为主要消毒成份的溶液。CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的。H2O2在酸性介质中稳定,是一种强氧化剂。
2提出假设:__________________________________________________________。
3实验验证:
|
实验主要步骤 |
实验主要现象 |
|
|
|
4得出结论:__________________________________________________________。
(2)该校根据“非典”消毒要求,急需配制0.2%过氧乙酸消毒液1m3,需要购进甲溶液_________瓶,乙溶液____________瓶。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com