
24.(12分)利用天然气合成氨的工艺流程示意如下:
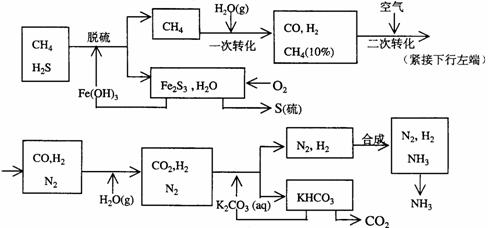
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质) 。
21.(6分)下列有关实验的叙述,正确的是(填序号) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
 22.(12分)下列试剂和中的仪器可用来制备氯气、溴单质、氧气和溴乙烷等。试剂有:二氧化锰、氯酸钾、氯化钾、溴化钾、双氧水、浓硫酸、乙醇、NaOH、水等。仪器见下图。
22.(12分)下列试剂和中的仪器可用来制备氯气、溴单质、氧气和溴乙烷等。试剂有:二氧化锰、氯酸钾、氯化钾、溴化钾、双氧水、浓硫酸、乙醇、NaOH、水等。仪器见下图。
请填空:
(1)组装制O2的发生装置选用的仪器是 (填仪器A~G编号,下同),
化学方程式为:
(2)利用 仪器可作为制溴单质的发生装置,制取反应方程式为________ ___________________________________.
(3)已知溴乙烷是一种难溶于水的无色液体,密度约为水的1.5倍,沸点为38.4℃乙醇沸
点为78.5℃;HBr的沸点为-67℃,Br2的沸点为58.8℃,密度为3.12g·cm3。
①收集溴乙烷时,选C和D,而不选D和E的理由是:
,
橡皮塞孔4接10端而不接11端的理由是:
。
②从棕黄色的粗溴乙烷中制取无色的溴乙烷,应加入的试剂是: ,
必须使用的主要仪器是 (填名称)。
20.可逆反应:3A(g)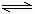 3B(?)+C(?)-Q,随着温度升高,气体平均相对分子质量有
3B(?)+C(?)-Q,随着温度升高,气体平均相对分子质量有
变小趋势,则下列判断正确的是
A. B和C可能都是固体 B. B和C一定都是气体
C.若C为固体,则B一定是气体 D. B和C可能都是气体
第Ⅱ卷(共80分)
19.利尿酸在奥运会上被禁用,其结构简式如题19图所示.下列叙述正确的是
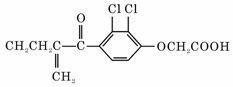 A.利尿酸衍生物利尿酸甲脂的分子式是C14H14Cl2O4
A.利尿酸衍生物利尿酸甲脂的分子式是C14H14Cl2O4
B.利尿酸分子内处于同一平面的原子不超过10个
C.1 mol利尿酸能与7 mol H2发生加成反应
D.利尿酸能与FeCl3溶液发生显色反应
18.下列叙述正确的是
A.0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液
一定呈碱性
B.常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7
C.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA‑)+2c(A2-)
D.将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液
的体积为10mL,则混合液的pH=2
17.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
A.上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可
供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为:C2H5OH-12e-=2CO2↑+3H2O
D.甲烷燃料电池的正极反应为O2+2H2O+4e-=4OH-
16.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制
CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌
使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
15.从下列事实所列出的相应结论正确的是
|
|
实 验 事 实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
14.下列反应的离子方程式错误的是:
A.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-==BaCO3↓+NH3·H2O+H2O
C.在溴化亚铁溶液中通入过量的氯气:Cl2+2Fe2++2Br-==2Fe2++2Cl-+Br2
D.过量CO2通入氢氧化钠溶液中:CO2+2OH-==CO32-+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com