
2.教材是学习的重要材料,但不能迷信教材。下列是中学化学教材中摘录的部分表述内容,根据你所学的化学知识判断,其中不够科学严密的是
A.第三册教材P20:除了加入电解质可使某些胶体聚沉外,将两种带相反电荷的胶体混合,也能发生聚沉。
B.第一册教材P17:离子方程式不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应。
C.第一册教材P101:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
D.第二册教材P34:不同的化学反应,具有不同的反应速率,这说明,参加反应的物质的性质是决定化学反应速率的重要因素。
1.1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的核素-30P,开创了人造核素的先河。其发生的变化可表示如下:27Al+4He→30P+1n。下列有关说法不正确的是
A.30P和 31P 两种核素互为同位素
B.该变化同样遵循质量守恒定律
C.该变化说明原子核在化学反应中也能发生变化
D.在30P中存在:质子数=中子数=核外电子数
28、在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:

(1)碘位于元素周期表中的第 周期,第 族。
(2)步骤①加Fe的目的是 。
(3)写出步骤②的化学方程式 。
(4)上述生产流程中,可以利用的副产物是 ,考虑原料循环利用,若将该副产物制成生产所需的试剂,先后还需加入 来进行处理。
(5)甲物质见光易变黑,其原因是(用化学方程式表示): 。
(6)第⑤步操作可供提纯I2的两种方法是 和 。
27、(10分)、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
 ②
Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
②
Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是
。
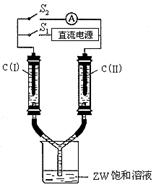
(3)如右图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(I)、C(II)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时C(I)的电极名称是 (填写正极或负极); C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
26、(11分)
25℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。
(1)若所得溶液的pH=11,且a=13,b=2,则Va︰Vb= 。
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4(填“可”或“否”)
,其理由是 。
(3) 为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为
AG=lg。25℃时,若溶液呈中性,则AG= ,溶液的pH与AG的换算公式为AG= (要简化)。
25、(8分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 ,
K值大小与温度的关系是:温度升高,K值 。
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g) + H2O(g)
 CO2(g) + H2 (g) △H1 <0
CO2(g) + H2 (g) △H1 <0
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)= mol/(L•min)

(3) t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于 状态;
C1数值 0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min-6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
24、(8分)2005年我国成功发射了“神州六号”载人飞船,标志着我国航天技术走在了世界前列。
(1)肼(N2H4)是发射航天飞船常用的高能燃料。将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,写出该反应的化学方程式: ;该反应的还原产物是 。
(2)在火箭推进器中装有强还原剂肼和强还原剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热。已知12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;1mol液态水变成1mol水蒸气需要吸收44kJ的热量。写出液态肼与过氧化氢反应生成液态水的热化学方程式: 。
(3)新型无机非金属材料在航天事业上有广泛应用。氮化硅陶瓷是一种重要的结构材料。氮化硅(Si3N4)晶体是一种超硬物质,耐磨损、耐高温。氮化硅晶体类型是 ;晶体中存在的化学键是 。
23、(12分)常温下,在没有氧气存在时,铁与水几乎不反应,但在高温下,铁能与水蒸气反应。请设计一套简单的实验装置,证明还原铁粉与水蒸气能够发生反应。
(1)在答题卡的方框中画出实验装置示意图(包括反应时容器中的物质),并用图中玻璃容器旁自左至右分别用A、B、C……符号标明。

①本题装置示意图中的仪器可以用下面的方式表示。
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。
(2)请写出在图上用A、B、C……各玻璃容器中盛放物质的化学式或名称。
A 、B 、C 、D 、E 。
(3)能够说明还原铁粉与水蒸气能够发生反应的实验现象(或操作)是
。
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法:
22、(8分)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g),现通过实验来测定混合物中Na2O2的质量分数。操作流程如下:

(1)操作Ⅱ的名称是
(2)需直接测定的物理量是
(3)测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、
(固定、夹持仪器除外)
(4)在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果
(填偏大、偏小或不变)。
21、(10分)用右图装置,进行硝酸与铜片反应的实验,同时,为了防止污染,在试管B里盛放足量氢氧化钠溶液,以吸收反应产生的气体。
(1)若实验使用的试剂是质量分数为63%的硝酸和小铜片,操作中怎样加入硝酸和铜片才能避免铜片与硝酸刚一接触时生成的气体外逸到空气中?________________________________________________ 。
(2)若使用的试剂是1mol•L-1的硝酸和小铜片,则A试管中所发生反应的化学方程式是_______________________________,实验结束后试管B中的溶液所含的溶质有(写化学式)_____________________________。
(3)为了从上述实验中获得纯净、干燥的NO,其方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com