
27. 将2 mol SO2和1 mol O2混合置于体积可变
将2 mol SO2和1 mol O2混合置于体积可变
的密闭容器中,在T1温度下发生如下反应:
2SO2(g)+O2(g) 2SO3(g)
+Q(Q>0)
2SO3(g)
+Q(Q>0)
当反应进行到时间t0点时达到平衡状态,测得混
合气体的总物质的量为2.1 mol。试回答:
(1)该反应的平衡常数表达式: 。
(2)反应进行到t0时SO2的的体积分数 。
(3)若保持温度为不变,使用催化剂,在图中作出
从反应开始到t0点这段时间SO2物质的量变化曲线。
(4)当反应进行到t1时间时(t1 >t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t2 时间时(t2>t1)重新达到平衡状 态,新平衡混合物中气体的总物质的量 ______2.1 mol(填“<”、“>”或“=”)。
26.在一容积为2L且容积不变的密闭容器中加入适量碳粉和0.2molH2O。在800 °C条件下,经20s后达到如下化学平衡:C(s) +H2O(g)  CO(g) + H2(g) + Q。已知达到平衡(I)时,CO为0.12mol。试回答:
CO(g) + H2(g) + Q。已知达到平衡(I)时,CO为0.12mol。试回答:
(1)写出上述反应平衡常数的表达式: ;
(2)若用υ(H2O)表示该反应前20s内的平均速率,则υ(H2O)= ;
(3)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新的平衡(II),则平衡时H2的物质的量 (填“增大”、“减小”、“不变”)。理由是:
。
(4)若向上述平衡(I)的混合物中再充入a mol H2( a < 0.12 ),在相同条件下达到新的平衡(III),此时,CO的物质的量n的取值范围是 。
25. NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
 NaNO2 + HI
NO + I2 + NaI + H2O
NaNO2 + HI
NO + I2 + NaI + H2O
(1)配平并标出电子转移的方向和数目。
(2)上述反应中氧化剂是 ,若有1 mol的还原剂被氧化,则参加反应的氧化剂物质的量是 mol。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:① 水 ② 碘化钾淀粉试纸 ③ 淀粉 ④ 白酒 ⑤ 食醋,进行实验,下列几组合适的是 (填序号)。
A.③ ⑤ B.① ② ④ C.① ② ⑤
(4)某厂废切削液中,含有2%-5%的NaNO2,直接排放会造成污染,下列试剂中:a. NaCl b. NH4Cl c. H2O2 d. 浓H2SO4 ,能使 NaNO2转化为不引起二次污染的N2是
(填序号),反应的化学方程式为 。
24.在短周期主族元素中
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是________(填元素名称)。
(2)铝是活泼的金属元素,把去除了表面氧化膜的铝条浸入硝酸汞溶液,片刻后取出,放置一段时间后,可看到铝条表面生成白色毛状物,生成该物质的化学方程式为_______________________________,该实验证实,铝之所以具有良好抗腐蚀能力,是因为 。美国化学家发现铝的“原子群”(如Al13、Al14、Al37)各具有与某种元素相似的化学性质,并符合元素周期律的某些规律。例如:Al13与卤素具有相似的化学性质, Al13-离子具有惰性气体元素的性质,可推测Al14的化学性质与 族元素相似。
(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p 亚层上有3个电子。
①写出甲元素的电子排布式____________________________。
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________晶体,其化学式为_______________,合成这种物质必需的反应条件是 。
23.有四种同族物质,它们的沸点(℃,1.01×105 Pa)如下表所示:
|
① |
He -268.8 |
Ne -249.5 |
Ar (x) |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(a) 58.7 |
I2 184.0 |
|
③ |
HF (y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O (z) |
H2S -60.2 |
(b) -42.0 |
H2Te -1.8 |
试根据上表回答:
⑴ a为 色液体;b的分子式是: 。
⑵ 写出②系列中物质主要化学性质的递变规律(任定一种): ;能够说明该递变规律的化学事实是(任举一例, 用离子方程式表示):
;
⑶ 除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是: 。
22.向100mL 0.1mol/L的NaOH溶液中通入224mL(标准状况下)CO2气体,恰好完全反应,则所得溶液中粒子浓度关系正确的是………………………………………( )
A.c (Na+ )=c (HCO3- )+c (H2CO3)+c (CO32- )
B.c (Na+ )>c (HCO3- )>c (H + )>c (CO32- )>c (OH - )
C.c (Na+ )+c (H + )=c (HCO3- )+c (OH - )+c (CO32- )
D.c (H + )+c (H2CO3)=c (CO32- )+c (OH - )
第Ⅱ卷(共84分)
11.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是…………………………………………………………………( )
A.中和时所需NaOH的量 B.电离度
C.H+的物质的量 D.CH3COOH的物质的量
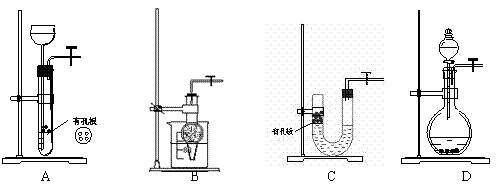
20.以下气体发生装置中,与启普发生器一样具有随开随停功能的是………………………………………………………………………………………( )

19.下图是电解饱和NaCl溶液的实验装置, X、Y都是惰性电极, a是饱和NaCl溶液, 同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是…………………………( )
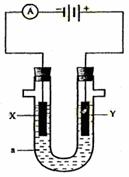 A.X电极为阳极,Y电极为阴极
A.X电极为阳极,Y电极为阴极
B.X电极附近溶液变红色,且有刺激性气味气体产生
C.若将两电极产生的气体收集起来,X电极得到的气
体与Y电极得到的气体之比略大于1:1
D.电解后,将溶液混匀,电解前后溶液的pH未发生变化
18.下列离子中,电子数大于质子数且质子数大于中子数的是……………………( )
A.D3O+ B.Li+ C.OD- D.OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com