
25.(6分)将一定量氧化铜粉末加入到100mL0.5mol/L的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10克充分反应后过滤,烘干,得干燥的固体物质仍为10克。
(1)参加反应的铁为多少克?
(2)原加入的氧化铜为多少克?
(3)最后得到的溶液仍为100mL,其物质的量浓度为多少?
24.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液 ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
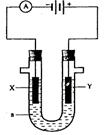 (1)若X、Y都是惰性电极,
(1)若X、Y都是惰性电极, 是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为__________。在X极附近观察到的现象是__________。
②Y电极上的电极反应式为_________,检验该电极反应产物的方法是__________。
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是_______,电极反应式为__________。
②Y电极的材料是_______,电极反应式为___________。
(说明:杂质发生的电极反应不必写出)
23.(10分)对溶液中的反应,下列图象中n表示生成沉淀的物质的量,v表示参加反应的一种反应物的物质的量,根据相关图象回答问题:
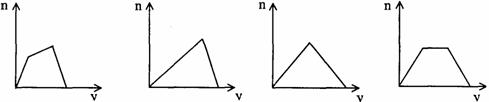
A B C D
(1)反应过程产生沉淀量符合A图像的两种反应物为 。
(2)反应过程产生沉淀量符合B图像的离子反应式为 。
(3)反应过程产生沉淀量符合C图像的离子反应式为 。
(4)反应过程产生沉淀量符合D图像的反应物为 。
22.(12分)A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行.已知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C都能生成气态非极性分子的化合物;③D与E生成离子化合物,其离子的电子层结构相同.回答:
(1)A为________元素(填名称,下同),B为________元素,C为________元素,D为________元素,E为________元素;
(2)C元素在周期表中属第________周期,________族元素;
(3)D与B形成的化合物的电子式________,属________晶体;
(4)C与E形成的化合物的电子式为____________和____________,属______晶体.
21.(8分)X、Y、Z为三个不同短周期非金属无素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是__________;
②生成固体C的化学方程式是_____________________________________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是_____________________;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是
______________________________________________________;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式
是__________________________________________。
20.(8分)某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是 ②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
。
19.(12分)有1、2、3、4号4瓶未知溶液,它们是NaCl(0.1mol/L)、HCl(0.1mol/L)、NaOH(0.1mol/L)和酚酞(0.1%)。某同学不用其他试剂,就把它们一一鉴别开来了,其实验步骤如下:
①各取溶液少许两两混合,据此分成两组。
②取一组混合液,不断滴入另一组的一种未知溶液,据此可鉴别出1号和2号。
③再取已鉴别出的1号溶液2mL,滴入3滴3号未知液,再加入4号未知溶液4mL,在这个过程中无明显实验现象。
综合以上实验,可以确定1号是 ,2号是 ,
3号是 ,4号是 。
18.273K、1.01×105Pa时,氢气和氧气的混合气体amL,点火爆炸后恢复到原温度和压强时,气体变为bmL,则原混合气体中氧气为
A.(a-b)mL B.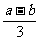 mL C.b mL
D.
mL C.b mL
D.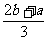 mL.
mL.
第Ⅱ卷(非选择题 共76分)
17.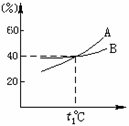 右图是A、B两物质的饱和溶液的质量分数随温度变化的曲线,现分别在50g A和80g B中加入水150g,加热溶解并都蒸去50g水后,冷却到t1℃。下列叙述正确的是
右图是A、B两物质的饱和溶液的质量分数随温度变化的曲线,现分别在50g A和80g B中加入水150g,加热溶解并都蒸去50g水后,冷却到t1℃。下列叙述正确的是
A.t1℃时溶液中A、B的浓度相等(质量分数)
B.t1℃时溶液中A的浓度小于B
C.t1℃时二者均无固体析出
D.t1℃时析出固体B
16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com