
19.(Ⅰ)据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是
A、O4分子内存在极性共价键 B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体 D、O4将来可用作更强有力的火箭推进的氧化剂
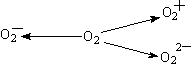
(2)含O2-、O22-甚至O2+的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:该反应中 (填序号)相当于氧分子的还原。
(3)化合物O2[PtF6]中含有O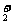 ,有一种常见的含有O
,有一种常见的含有O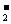 的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式: __________________________________________
的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式: __________________________________________
(Ⅱ).发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
⑴ 写出N2的电子式________________;
⑵ 液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为________________________;
⑶ 25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度___________(填“大于”、“等于”或“小于”)0.1 mol·L-1 NaOH水溶液中水的电离程度。若将0.1 mol·L-1 NaOH和0.2 mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为__________________________________。
⑷ 在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+ H3O+
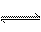 N2H5+ + H2O N2H4
+ H2O
N2H5+ + H2O N2H4
+ H2O  N2H5+ + OH-
N2H5+ + OH-
N2H5+ + H2O
 N2H62+ + OH- N2H5+
+ H2O
N2H62+ + OH- N2H5+
+ H2O  N2H4 + H3O+
N2H4 + H3O+
据此可得出的结论是_______________;
A.肼水解显酸性 B.肼在水中电离出H+离子C.肼是二元弱碱 D.肼是二元弱酸 .
⑸ 完成下列反应方程式并配平:
__NH3 + ___NaClO == ___NaCl + ___N2H4 + ___ ___________;
⑹ 发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4 gN2H4(g)上述反应中放出71kJ的热量,写出该反应的热化学方程式
___________________________________________________________.
18.(9分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
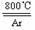 TiO2
+2C+2Cl2
TiO2
+2C+2Cl2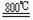 TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
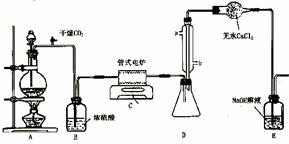
①连接好整套装置,在通Cl2前先从侧管中通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中反应的离子方程式为__________________________________ 。
⑶ 装置D中冷凝管进水口的位置是(填a或b)___ 。
⑷ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑸ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,氩气的作用为__ 。
17.(11分)(1) 下列有关实验操作或判断不正确的是 ______(填有关序号,选错倒扣分)。
A.用10 mL量筒量取稀硫酸溶液 8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
F.测定硫酸铜晶体中结晶水含量时,将加热后的坩埚置于干燥器中冷却后再称量
G.用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
(2)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下: 2MnO4-+5C2O42-+16H+ 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
 ①用托盘天平称取W g Na2C2O4晶体。
①用托盘天平称取W g Na2C2O4晶体。
②将W g Na2C2O4配成100 mL标准溶液,移取20.00 mL置于锥形瓶中,则酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中。
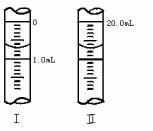
③若滴定管的起始读数和终点读数如右图所示,则酸性KMnO4的物质的量浓度为________ (填表达式)。
④若滴定完毕立即读数,测定的KMnO4溶液的浓度________(填“偏高”“偏低”或“不变”)。
16.经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是
A.溶液中四种粒子之间不可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液呈酸性,则一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.若溶液呈碱性,则一定满足:c(NH4+)>c(Cl-)
D.若溶液呈中性,则一定满足:c(NH4+)= c(Cl-)
第二卷 (共86分)
15.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原 B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
14.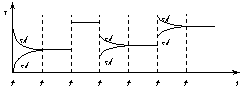 某密闭容器中发生如下反应:X(g)+3Y(g)
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度C.t5时增大了压强 D.t4-t5时间内转化率最低
2Z(g);ΔH<0右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度C.t5时增大了压强 D.t4-t5时间内转化率最低
13.对于平衡体系:aA(g)+bB(g) cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为M+bmol,则a+b=c+d
D.若a+b=c+d ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。
12.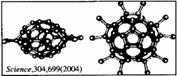 2004年4月30号出版的《Science》杂志报道了中国科学家郑兰荪院士首次成功合成新型稳定小富勒烯C50Cl10,外侧有10个氯原子,其形状酷似太空船。有关C50Cl10的说法正确的是
2004年4月30号出版的《Science》杂志报道了中国科学家郑兰荪院士首次成功合成新型稳定小富勒烯C50Cl10,外侧有10个氯原子,其形状酷似太空船。有关C50Cl10的说法正确的是
A. C50Cl10摩尔质量为955 g/mol
B. B.C50Cl10晶体是原子晶体
C.C50Cl10分子中含有25个碳碳双键 D.C50Cl10分子中共用电子对数目为105个
11.在一定温度下,向饱和的氢氧化钠溶液中加入少量的过氧化钠,充分反应后,恢复到原来温度,下列说法正确的是
A.溶液中Na+浓度增大,有O2放出 B.溶液pH不变,有O2放出
C.溶液中Na+数目减少,有O2放出 D.溶液中Na+数目不变,有O2放出
10.下列反应的离子方程式正确的是
A.苯酚钠溶液中通入少量CO2:2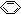 -O-+CO2+H2O→2
-O-+CO2+H2O→2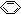 -OH+CO32-
-OH+CO32-
B.FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O
C.用氨水吸收少量的SO2:NH3·H2O+SO2=NH4++HSO3-
D.碳酸氢钠溶液中加入过量石灰水HCO3-+OH-=CO32-+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com