
28.(23分)为验证氯气的有关性质,试根据所提供的有关实验用品,回答下列问题。
实验用品:氯气发生装置、烧杯、试管、红色布条、AgNO3溶液、Na2CO3溶液、
NaOH溶液、KI-淀粉溶液、蒸馏水
 (1)溶于水中的部分氯气与水发生反应:Cl2 + H2O HClO + HCl。因此,新制氯水中含有多种粒子,当与不同物质反应时,将分别体现不同性质。
(1)溶于水中的部分氯气与水发生反应:Cl2 + H2O HClO + HCl。因此,新制氯水中含有多种粒子,当与不同物质反应时,将分别体现不同性质。
①能证明新制饱和氯水中还存在氯气分子的现象是
②欲证明氯水具有漂白性,可向样品溶液中加入 ,氯水具有漂白性的原因是氯水中含有 粒子。
③欲证明氯水中含有盐酸,可分别向样品溶液中加入 试剂,反应的离子方程式是 、 。
(2)检验氧化氢气体中是否混有氯气,可采用的方法是 ( )
A.用鲜艳的野花 B.用干燥的蓝色石蕊试纸
C.将气体通入硝酸银溶液中 D.用湿润的淀粉碘化钾试纸
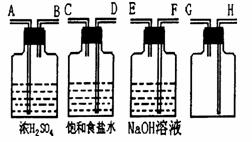 (3)实验室制取氯气的反应方程式为
(3)实验室制取氯气的反应方程式为
欲收集到纯净干燥的氯气,需将
从氯气发生装置中产生的气体经
过除杂处理,选用下图装置其接
口顺序(用字母表示)为
27.(13分)A、B、C、D是按原子序数由小到大排列的第二、三周期的单质。B、E均为组成空气的成分。F的焰色反应呈黄色,在C中,非金属元素与金属元素的原子个数比为1:2,在一定条件下,各物质之间的相互转化关
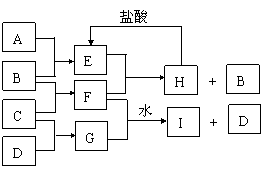 系如(图中部分产物未列出):
系如(图中部分产物未列出):
请填空下列空白:
(1)B是 ,C是
(2)H与盐酸反应生成E的化学方程式是
(3)E与F反应的化学方程式是
(4)F与G的水溶液反应生成I和D的离子方程是:
26.(10分)A、B、C、D、E5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式是
(2)A是 ,其推断依据是 D是
(3)A与E反应的离子方程式是
13.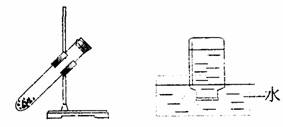 右图装置可用于
( )
右图装置可用于
( )
A.用固体NaHCO3制CO2
B.用二氧化锰和浓盐酸制氯气
C.用Zn和稀硫酸制氢气
D.用二氧化锰和氯酸钾制氧气
第Ⅱ卷(非选择题)
11.浓度为0.2 mol/L的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是 ( )
A.BaCl2、NaOH、NaHCO3 B.Na2CO3、MgCl2、H2SO4
C.AlCl3、NH3.H2O、NaOH D.Ba (OH)2、CaCl2、Na2SO4
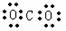 12.下列说法正确的是 ( )
12.下列说法正确的是 ( )
A.CO2的电子式为:
B.任何原子的原子核均含有质子和中子
C.常温常压下,气态单质的分子都是由非金属元素的原子形成的
D.常温常压下,只有一种元素的单质呈液态
10.下列说法正确的是 ( )
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
9.下列反应的离子方程式书写正确的是 ( )
 A.向含0.5molFeBr2的溶液中通入0.5molCl2:2Fe2+ + Cl2 2Fe3+
+ 2Cl-
A.向含0.5molFeBr2的溶液中通入0.5molCl2:2Fe2+ + Cl2 2Fe3+
+ 2Cl-
B.澄清石灰水中滴加少量Ca (HCO3)2溶液:
 Ca2+
+ OH- + HCO3- H2O + CaCO3↓
Ca2+
+ OH- + HCO3- H2O + CaCO3↓
 C.石灰石粉末溶于盐酸:CO32- + 2H+ H2O +
CO2↑
C.石灰石粉末溶于盐酸:CO32- + 2H+ H2O +
CO2↑
 D.过氧化钠溶于水:O22- + 2H2O 4OH- + O2↑
D.过氧化钠溶于水:O22- + 2H2O 4OH- + O2↑
8.A、B、C、D、E均为短周期元素.A、B、C位于同一周期邻位置,它们分别与D形成的化合物分子中都有10个电子,且A和C的原子序数之比为3 :4.E原子从内到外各电子层的电子数之比为1 :4 :1,则下列叙述正确的是 ( )
A.由A和C形成的一种化合物能与E的单质在一定条件下发生置换反应
B.由A、C原子和B、D原子分别构成的分子都是极性分子
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不含离子键
7.下列说法正确的是 ( )
A.配制稀硫酸时,先在量筒中加一定体积的水,再边搅拌边慢慢加入浓硫酸
B.金属钠着火时,可用泡沫灭火器灭火
C.燃着的酒精灯打翻失火,应立即用水扑灭
D.手上滴了浓硫酸立即用大量水冲洗
6.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 molNa作还原剂可提供的电子数为NA
B.0.5 mol Na2O2与足量水充分反应,转移的电子数为NA
C.5.6gFe与足量Cl2完全反应,转移的电子数为0.2NA
D.11.2LCl2与4.25gNH3所含有的原子数均为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com