
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.Fe、Cu与稀H2SO4构成原电池,转移NA个e一时,产生气体体积为11.2L
B.通常状况下将O.5mol HI气体和0.5 mol C12混合后,气体的分子数为NA
C.标准状况下O.5 NA个Br2所占的体积约为11.2L
D.53 g Na2C03固体含有的离子数为1.5 NA
3.生活离不开化学,下列有关说法正确的是( )
A.乙醇和汽油都是可再生能源,应大力推广使用“乙醇汽油”
B.太阳能电池可采用硅材料制作,其应用有利于环保、节能
C.棉花、蚕丝和人造丝的主要成分都是纤维素
D.凡含有食品添加剂的食物均对人体有害,不宜食用
2.在298K下,如将1mol蔗糖溶解在1 L水中,此溶解过程中体系的△H-T△S和熵的变化情况是( )
A.△H-T△S>0,△S<O B.△H一T△S<O,△S>O
C.△H-T△S>0,△S>O, D.△H-T△S<0, △S<0
1.分类法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是( )
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物和两性氧化物
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
⑤根据水溶液是否能够导电将化合物分为电解质和非电解质
A.②④ B.②③④ C.①③⑤ D.①②④⑤
32.(8分)[化学-有机化学]
BPO是使面粉增白的一种添加剂,分子结构有两个苯环的.BPO只含有C、H、O三种元素,其相对分子质量不超过250,氧元素的质量分数约为26.45%。BPO可通过下列方法得到(反应条件略)。

已知:一个C上连有两个-OH不稳定,易失H2O。
(1)写出A的结构简式:___________;
反应①的反应类型:___________。
(2)写出反应②的化学方程式:____________。
(3)BPO分子结构对称,且分子中含有过氧键(-O-O-),不能发生银镜反应,试写出 BPO的结构简式:_____________。
31.(14分)某研究性学习小组在探究铜、锌与浓盐酸的反应时,设计了如下实验方案:
实验用品:纯锌片、37%浓盐酸、铜片、蒸馏水、氯化铜溶液。
甲同学:将锌片放入浓盐酸中,反应速率较快
乙同学:将实验过程记录下来,并进行交流

根据上述资料与交流材料回答下列问题:
(1)乙反应速率明显比甲快,原因是________________________________。
(2)丙、丁两同学根据铜位于金属活动顺序表中氢之后,与盐酸不反应,对乙产生的气体比甲多的事实作出如下推断:
①丙同学认为是溶解在溶液中的氢气逸出,你认为是否有道理并说明理由:______
②丁同学作了如下猜想,验证是否成立,请你设计实验方案:

(3)戊同学注意到“交流卡片”中的(3)中的白色沉淀,分析:不可能是CuCl:,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液浓度更小,不会析出。他利用“资料卡片”中的①②大胆猜想白色沉淀是生成的氯化亚铜。请你帮助他设计验证方案:(若有多个方案,只设计一个即可)



 (4)指导老师肯定了戊同学的猜想,将反应后的溶液稀释后生成沉淀,实际上是一个平衡 问题,用离子方程式表示这一平衡关系为[CuCl4]3-(aq)
(4)指导老师肯定了戊同学的猜想,将反应后的溶液稀释后生成沉淀,实际上是一个平衡 问题,用离子方程式表示这一平衡关系为[CuCl4]3-(aq) CuCl(s)+3C1-或 [CuCl3]
CuCl(s)+2C1- 或[CuCl2]-
CuCl(s)+ Cl-。写出铜与足量浓盐酸在加热条件下反应生成无色溶液及气体的一个化学方程式_________________。
CuCl(s)+3C1-或 [CuCl3]
CuCl(s)+2C1- 或[CuCl2]-
CuCl(s)+ Cl-。写出铜与足量浓盐酸在加热条件下反应生成无色溶液及气体的一个化学方程式_________________。
[选做部分]
共3个题。考生从中选择1个物理题、1个化学题作答.
30.(14分)氯气是一种很重要的工业原料,很多化学物质成分中均含有氯,如饮用水常用的消毒剂等。三氯化磷是无色液体,是重要的化工原料,可用来制造许多磷的化合物,如敌百虫等农药。
科学家舍勒在化学上的另一个重要贡献是发现了氯气。一般情况下,实验室中常用较强的氧化剂如MnO2、PbO2、KmnO4、KclO3、Ca(ClO)2等]氧化浓盐酸制取氯气。
(1)写出用PbO2和浓盐酸反应制取氯气的化学方程式____________,铅元素在元素周期表中的位置是_______;已知PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应的离子方程式________________________。
(2)现用漂粉精和浓盐酸制取氯气,漂粉精与盐酸可能发生的化学反应方程式为
________________________ , ________________________
(3)磷在氯气中燃烧可生成无色液体PCl3和淡黄色晶体PCl5,PCl3还可继续与氯气作用生成PCl5,PCl3和PCl5均可与水反应;PCl5受热可以分解为PCl3和氯气。
①将红磷(P)与氯气按2:5的物质的量比混合放在密闭容器中高温时发生反应,所得主要产物是________________________。
②已知PCl3分子为三角锥形结构,键角为100°,与水反应生成H3PO3和HCl,H3P03与足量NaoH反应的产物是Na2HPO3,则在下列物质中各原子最外层均达到8电子结构的是__________________。
A.PCl3 B.PCl5 C.Na2 HPO3
③水在液态时存在H3O+ 和OH-,液氨中存在NH4+ 和NH2,PCl5在一定条件下也存在类似水和氨的解离方式,其中一种呈四面体结构,则其解离产生的两种离子分别是________________________。
29.(14分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底 有极其丰富的“可燃冰”资源。
①“可燃冰”从海底取出后,将融化并放出甲烷气体。试解释其原因:
②取356g分子式为CH。·9H。O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1780.6kJ的热量,则甲烷的燃烧热为_________,甲烷燃烧的热化学方程式为_______。
(2)设计出能使液化石油气氧化直接产生电流的燃料电池是新世纪最富有挑战性的课题 之一。最近有人制造了一种燃料电池,一个电极通人空气,另一电极通人液化石油气(以C4H10表示),电池的电解质是掺人了Y2O3的ZrO2晶体,它在高温下能传导 O2-
①已知该电池的负极反应为: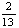 C4H10+2O2-4e-=
C4H10+2O2-4e-=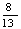 CO2+
CO2+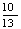 H2O,则该电池的正极反应为_______,电池工作时,固体电解质里的O2-向_______极移动。
H2O,则该电池的正极反应为_______,电池工作时,固体电解质里的O2-向_______极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的_______ (填写物质的名称)堵塞电极的气体通道。
(3)能源的紧缺在很大程度上制约着经济的发展,请你提出解决能源紧缺问题的两点建 议_______。
15.将KCl和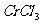 两种固体混合物共熔发生化合反应制得化合物X。将1.892gX中Cr元素全部氧化成
两种固体混合物共熔发生化合反应制得化合物X。将1.892gX中Cr元素全部氧化成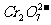 ,
,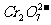 可与过量的KI发生氧化还原反应,得到2.667g
可与过量的KI发生氧化还原反应,得到2.667g  ,反应的离子方程式为:
,反应的离子方程式为: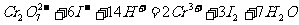 。如果取溶有1.892g X的溶液,加入过量的
。如果取溶有1.892g X的溶液,加入过量的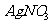 溶液,可得到4.52gAgCl沉淀,则表示X组成的化学式为
溶液,可得到4.52gAgCl沉淀,则表示X组成的化学式为
A.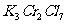 B.
B.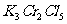 C.
C.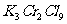 D.
D.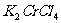
第Ⅱ卷(必做136分+选做16分,共152分)
[必做部分]
14.25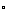 C时,将稀氨水逐滴加入到稀硫酸中,当溶液的,pH=7时,下列关系正确的是
C时,将稀氨水逐滴加入到稀硫酸中,当溶液的,pH=7时,下列关系正确的是
A.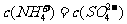 B.
B.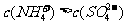
C. D.
D.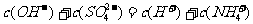
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com