
22.(10分)有下列六种溶液:
A.NaOH溶液;B.Ba(OH)2溶液;C.Al2(SO4)3溶液;D.KAl(SO4)2溶液;E.混有少量HNO3的MgSO4溶液;F.FeCl3溶液。任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
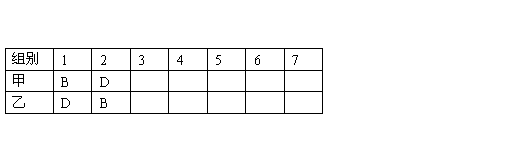 (1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满):
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满):
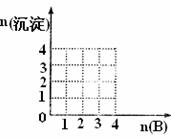
 (2)请在上面坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液中溶质中物质的量变化的曲线(设D溶液中含1mol溶质)。
(2)请在上面坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液中溶质中物质的量变化的曲线(设D溶液中含1mol溶质)。
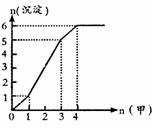
(3)右图是某一组实验中所得沉淀的物质的量(n沉淀/mol)
随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。
若实验时取用的乙溶液为500mL,试计算乙溶液中
溶质的物质的量的浓度。
21.(8分)合成氨工业对化学工业和国防工业具有重要意义,对我国实现农业现代化起着重要作用。根据已学知识回答下列问题:
 已知N2 (g) + 3H2 (g) 2NH3(g) △H =-92.4kJ·mol-1
已知N2 (g) + 3H2 (g) 2NH3(g) △H =-92.4kJ·mol-1
(1)合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填序号);
A.采用较高压强(20MPa ~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
(2)合成氨工业中采用了较高压强(20MPa ~50MPa),而没有采用100MPa或者更大压强,试解释没有这么做的理由 ;
(3)在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示),此时α甲 α乙(填“>”、“<”“=”)。
20.(8分)将化学知识系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:从不同的角度,化学反应可以有不同的分类方法。请在右下方的右框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系(每类反应各用一个圆圈表示)。
问题2:化学反应的发生是有条件的。反应物相同,反应条件不同,
产物不同(列举一例,用化学方程表示,下同): 、
;反应物相同,浓度不同,产物不同: 、
;
问题3:得到同样产物的途径是多样的。反应物不同,反应条件相
同,产物相同: 、 。
19.(9分)物质的分离和提纯有多种方法。物质分离、提纯方案的设计在科学研究和工业生产中占有十分重要的地位。
(1)工业上冶炼铝的原料是铝土矿(主要成份为Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

①写出X、Y的化学式:X ,Y ;
②通入过量CO2时反应的离子方程式为
。
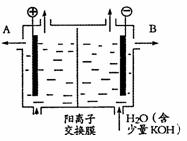 (2)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,
(2)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,
可用离子交换膜法电解提纯。电解槽内装有阳离子
交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式为 ;
②通电开始后,阴极附近溶液pH会增大;其原因是
;
③除去杂质后的氢氧化钾溶液从液体出品
(填写“A”或“B”)导出。
18.(8分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
 ②粗硅与干燥的Cl2反应制得SiCl4:Si + 2Cl2 SiCl4
②粗硅与干燥的Cl2反应制得SiCl4:Si + 2Cl2 SiCl4
③SiCl4被过量H2在1000℃~1100℃时还原制得纯硅
某同学从资料中查知:SiCl4熔点为-70℃,沸点为57.6℃,在潮湿的空气中能发生水解反应。该同学设计了以下SiCl4制取纯硅的实验装置(热源及夹持装置略去)。
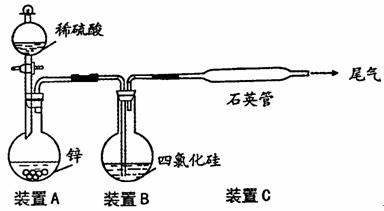
请回答下列问题:
(1)为使SiCl4从装置B中比较均匀的逸出,对装置B采取的措施是
;
(2)装置C不能采用普通玻璃管的原因是 ;
(3)如果从A中直接快速向B中通入气体,可能观察到的现象是
;
(4)为防止空气污染,应将尾气通入盛有 溶液的烧杯中;
(5)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是 。
17. (7分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料信息如下:
(7分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料信息如下:
①酸性:H2SO4 > H2seO4 > H2TeO4
②氧、硫、硒与氢气化合越来越难,碲与氢气不能直接化合
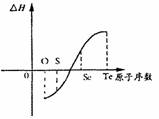
③由元素的单质生成等物质的量的氢化物的焓变情况如图:
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放出”或“吸收”)
(2)已知H2Te分解反应的△S>0,请解释为什么Te和H2不能
直接化合 ;
(3)上述资料信息中能够说明硫元素非金属性强于硒元素的是 (填序号);
(4)仅有氧族元素构成的微粒中,与HS-含相同电子数的有 。
16.室温下,在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,混合溶液的pH随加入的醋酸体积的变化曲线如下图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系比较错误的是 ( )
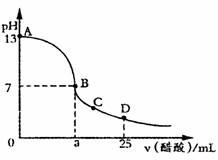 A.在A、B间任一点,溶液中一定都有
A.在A、B间任一点,溶液中一定都有
c(Na+) +c (H+) = c (CH3COO-) + c(OH-)
B.在B点:a > 12.5,且有
c(Na+) = c (CH3COO-) > c(OH-) = c (H+)
C.在C点:
c(Na+) > c (CH3COO-) >c (H+) > c(OH-)
D.在D点:
c (CH3COO-) + c(OH3COOH) = 0.1mol·L-1
第Ⅱ卷(非选择题 共60分)
15.金刚石和石墨的氧气中燃烧的热化学方程式为:
C(金刚石、s)+O2(g)= CO2(g) △H =-395.41KJ·mol-1
C(石墨、s)+O2(g)= CO2(g) △H =-395.51KJ·mol-1
则下列热化学方程式正确的是 ( )
A.C(石墨、s)= C(金刚石,s) △H =-788.92KJ·mol-1
B.C(石墨、s)= C(金刚石,s) △H = +788.92KJ·mol-1
C.C(石墨、s)= C(金刚石,s) △H =-1.9KJ·mol-1
D.C(石墨、s)= C(金刚石,s) △H = +1.9KJ·mol-1
13.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是 ( )
A.Y元素最高价氧化物对应水化物的化学式为H2YO4
B.原子序数由小到大的顺序为W<X<Y<Z
C.X与W可以形成W2X、W2X2两种化合物
D.Y、Z两元素的简单离子的半径Y>Z
|
A.硫酸铜的溶解度 B.溶液的质量
C.溶液中溶质的质量分数 D.溶液中Cu2+的数目
12.有人认为CH2 = CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2 = CH一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2 = CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是( )
A.BrCH2CH2Br B.ClCH2CH2Cl C.BrCH2CH2I D.BrCH2CH2Cl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com