
26.(10分)
硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热浸泡一会,除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置.冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广囗瓶中,密封保存。
请回答下列问题:
(1) 实验步骤①的目的是 ,
加热的作用是___________________ _。
(2) 实验步骤②明显不合理,理由是_______________________
。
(3) 实验步骤④中用少量冰水洗涤晶体,其目的是
_____________ 、_______ 。
(4) 经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到
FeSO4·7H2O.FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成,如下表
所示(仅在56.7℃.64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
请根据表中数据,若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为_________ 。
25.(6分)
实验室用铜和硫酸制取CuSO4有几种方法:
|
乙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2 ==2CuO; CuO+H2SO4 == CuSO4+H2O。对比甲的方案,乙同学的优点是: ;
为了同样达到乙同学的优点,你能不能根据电化学原理也设计一个用铜和稀硫酸制取CuSO4的方案?(其它材料任选):
24.(8分)
某无色溶液可能是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3、(NH4)2 SO4溶液中的两种混合而成。取该溶液,向其中加入稀硫酸,有白色沉淀生成;继续加入稀硫酸,沉淀又完全消失,整个实验过程中无气体产生。
(1)原溶液是由 和 溶液混合而成的。
(2)从混合开始的整个实验过程中,有关反应的离子方程式
是: 、 、 。
23.(4分)
有下列类卤分子及其相应的阴离子:(CN)2和CN-或(SCN)2和SCN-,性质类似于X2和X-,如Cl-的还原性比Br-弱,Br2的氧化性比(SCN)2强。在亚铁盐溶液中通入适量的氯气,再滴加KSCN溶液,溶液显___________色,而在KSCN溶液中先通入足量的氯气,再加入含有Fe3+的盐溶液,溶液不能显红色,这是因为__________ 。
22.(9分)
(1)测定HCl和NaOH反应的中和热时,每次实验均应测量三个温度是:
① ② ③ 。
(2)由“C(石墨)== C(金刚石);△H= +119 kJ/mol ”可知金刚石比石墨 (填“稳定”或“不稳定”)
(3)在稀溶液中: H++OH-=H2O;放出热量57.3kJ,则稀硫酸与稀氢氧化钠溶液反应,中和热的热化学方程式为: 。
(4)在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 。
21.(3分)
对某酸性溶液(可能含有Br-、SO42-、H2SO3、.NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略显橙黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
不能确认其在原溶液中是否存在的离子是 。
20.关于氢键,下列说法正确的是
A.分子间形成的氢键使物质的熔点和沸点升高
B.冰中存在氢键,水中不存在氢键
C.每一个水分子内含有两个氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
第Ⅱ卷(非选择题,共7 题,共50分)
19.下列反应的离子方程式正确的是
A.铁和稀硝酸反应 Fe+2H+===Fe2++H2↑
B.电解饱和食盐水
2Cl-+2H+ H2↑+C12↑
H2↑+C12↑
C.向溴化亚铁溶液中通入过量的氯气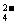 2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
D.向偏铝酸钠溶液中加入少量的NaHSO4溶液 AlO2- + H+ + H2O === Al(OH)3 ↓
18.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol 氢气中的化学键消耗的能量为Q1 KJ,破坏1mol氯气中的化学键消耗的能量为Q2 KJ,形成1mol HCl中的化学键释放的能量为Q3 KJ。则下列关系中正确的是
A.Q1 + Q2 =Q3 B. Q1 + Q2 >2Q3
C.Q1 + Q2 <Q3 D.Q1 + Q2 <2Q3
17.用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
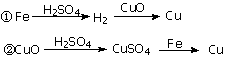
若按实验原则进行操作,则两者制得单质铜的量为
A.一样多 B.①多 C.②多 D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com