
30. (6分)在室温下,向100mLCu (IO3)2饱和溶液中加入足量的经酸化的KI溶液,发生如下反应:5I- + IO3-+6H+ = 3I2 + 3H2O 2Cu2+ + 4I- = 2CuI + I2
反应后,用0.1 1mol·L-1Na2S2O3溶液滴定(I2 + 2S2O32- = 2I- + S4O62-)
消耗了35.5mLNa2S2O3溶液。计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度。
(2)若Cu(IO3)2饱和溶液的密度为1.0g·cm-3,室温时Cu(IO3)2的溶解度是多少?
29. (10分)有A、B、C、D四种无色可溶性盐溶液分别由Na+、Mg2+、Ag+、Ba2+、Cl-、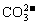 、HCO3-、NO3-中不同的阴阳离子所组成。A溶液与硫酸反应只有气体生成,B溶液与硫酸反应只有沉淀生成,C溶液与硫酸反应既有气体又有沉淀生成,D溶液与硫酸反应既无气体又无沉淀生成。
、HCO3-、NO3-中不同的阴阳离子所组成。A溶液与硫酸反应只有气体生成,B溶液与硫酸反应只有沉淀生成,C溶液与硫酸反应既有气体又有沉淀生成,D溶液与硫酸反应既无气体又无沉淀生成。
(1)写出A、B、C、D四种溶液中溶质的化学式:
A 、B 、C 、D
(2)分别写C与H2SO4和NaOH反应的离子方程式:
①C与足量H2SO4反应
②C与足量NaOH反应
③C与少量NaOH反应
28. (6分)我国缺碘病区甚广,防止缺碘病的主要措施是食盐加碘。1996年我国政府以国家标准的方式规定食盐的碘添加剂是KIO3。
(1)可用盐酸酸化的KI和淀粉的混合物检验食盐是否为加碘盐,反应的离子方程式为 。
(2)可用电化学方法制备KIO3。原理是:以石墨为阳极,不锈钢为阴极,以KI溶液(加入少量K2Cr2O7)为电解质溶液,在一定电流强度和温度下进行电解。其电解总反应方程式为
试写出两极的反应式:
阳极: ;
阴极: 。
27. (4分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
;若1g水蒸气转化成液态水放热2.4kJ,则氢气的燃烧热为 。
26. 测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨;②在坩埚中称量样品mg,并记录装有试样的坩埚的质量m1g;③加热;④冷却;⑤称量;⑥重复③~⑤的操作,直到连续两次称量的质量差不超过0.1g为止,记录最后所得数据m2g;⑦根据实验数据计算硫酸铜结晶水的含量。请回答下列问题:
(1)现有坩埚、坩埚坩、三脚架、泥三角、玻璃棒、托盘天平(带砝码)、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是 。
(2)在用托盘天平称量空坩埚的质量时,如果天平的指针向左偏转,说明
。
(3)该实验中,步骤④应在 (填仪器名称)中进行。这样操作的目的是 ,否则测定结果会 (填偏高,偏低)。
(4)实验步骤⑥的目的是 。
(5)根据测得的数据,计算出硫酸铜晶体里结晶水的分子数 。
(6)若操作正确而实验测得硫酸铜晶体中结晶中的含量偏低,其原因可能有(填选项的编号) 。
A. 被测样品中含有加热不挥发的杂质
B. 被测样品中含有加热易挥发的杂质
C. 实验前被测样品已有部分失水
D. 加热前所用坩埚未完全干燥
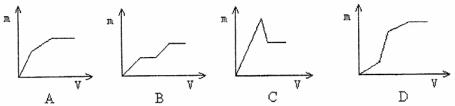
25. 向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀量m与加入的体积V之间的关系不可能是下图中的 ( )
第Ⅱ卷(非选择题,共50分)
24. 在反应11P + 15 CuSO4+ 24H2O=5Cu3P + 6H3PO4 + 15H2SO4中,1mol CuSO4能氧化P原子的物质的量是 ( )
A.  mol B.
mol B.
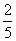 mol C.
mol C.
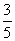 mol D.
mol D.
 mol
mol
23. 在一定条件下化学反应2SO2(g)+O2(g) 2SO3(g);△H =-197kJ·mol-1。现有容积固定且相同的甲、乙、丙三个容器,在上述条件下充入的气体和反应放出的热量(Q)如下表所列:
2SO3(g);△H =-197kJ·mol-1。现有容积固定且相同的甲、乙、丙三个容器,在上述条件下充入的气体和反应放出的热量(Q)如下表所列:
|
容器 |
SO2 (mol) |
O2 (mol) |
N2 (mol) |
Q (kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是 ( )
A. 在上述条件下反应生成1 molSO3气体放热98.5kJ
B. 在上述条件下,每摩尔该反应进行到底时放出的热量为197kJ
C. Q1 = 2Q2 = 2Q3 = 197
D. 2Q2 = 2Q3 < Q1< 197
22. 现有一份CuO和Cu2O的混合物,用H2还原法测定其中CuO的质量X(g)。实验中可以测得的数据有:①混合物质量;②生成水的质量;③生成Cu的质量;④消耗H2在标准情况下的体积。由以上数据中的某两个可算出X,这样的数据组合共有 ( )
A. 3种 B. 4种 C. 5种 D. 6种
21. t℃时,甲、乙两个烧杯中各盛有100g相同浓度的KCl溶液(密度为1.10g·cm-3)。现将甲烧杯中的溶液蒸发掉35.0gH2O,恢复到t℃时,析出KCl 5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时时,析出KCl 10.0g,下列说法不正确的是 ( )
A. 原溶液的质量分数为25%
B. t℃时,KCl的溶解度为50.0g
C. 原溶液的物质的量浓度为3.7mol·L-1
D. 乙烧杯中剩余KCl溶液质量分数大于甲烧杯中剩余KCl溶液的质量分数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com