
8、在1L密闭容器中通入2mol
NH3,在一定温度下发生反应;2NH3  N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是 ( )
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是 ( )
A.6mol H2和2mol N2 B.2mol NH3和1mol N2
B.2mol N2和3mol H2 D.0.1mol NH3、0.95mol N2、2.85mol H2
7、现有反应的化学方程式为aFeCl2+bKNO3+cHCl=d FeCl3+eKCl+fX+gH2O若b=1,d=3,X为生成物,其分子式应为 ( )
A. NH4Cl B. NO2 C. NO D. N2
6、
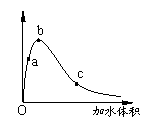 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
c<a<b
5、 反应2X(g)+Y(g)
反应2X(g)+Y(g) 2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图2-16所示。则下述判断正确的是 ( )
2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图2-16所示。则下述判断正确的是 ( )
A.T1<T2,p1<p2 B.T1<T2,p1>p2
C.T1>T2,p1>p2 D.T1>T2,p1<p2
4、2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160 kJ/mol,而N≡N的键能为942 kJ/mol(键能表示形成化学键释放的能量或者破坏化学键消耗的能量)。则下列有关说法不正确的是 ( )
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
3、已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是 ( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
2、某温度下, 在固定体积的密闭容器中, 可逆反应 A(g) + 3B(g)  2C(g)
达到平衡时, 各物质的物质的量之比为 A : B : C = 2 : 2 : 1, 保持温度不变, 以 2 : 2 : 1 的物质的量之比再次充入A、B、C, 则
( )
2C(g)
达到平衡时, 各物质的物质的量之比为 A : B : C = 2 : 2 : 1, 保持温度不变, 以 2 : 2 : 1 的物质的量之比再次充入A、B、C, 则
( )
A. 平衡正向移动
B. 平衡不移动
C. 平衡时C的体积分数增大
D. 平衡时C的体积分数可能变小
1、在2A+B  3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1
B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1
D.v(D)=1 mol·L-1·s-1
2.(7分)有H2SO4和HCl的混合溶液20mL,在此溶液中加入0.25mol·L-1的Ba(OH)2溶液时,滴入Ba(OH)2溶液的量与生成硫酸钡的量及所形成溶液的pH有如下图所示的关系。
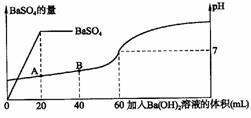
问:(1)最初的混合溶液中H2SO4和HCl的物质的量浓度各为多少?
(2)在上图中,A点所示溶液的pH是多少?(注:lg2=0.301,lg5=0.69,答案保留两位有效数字,溶液密度变化及析出沉淀对溶液体积的影响忽略不计)
1.(6分)某一烷烃和单烯烃混合气体的平均相对分子质量为22.5,取标准状况下的此混合
气体4.48L,将其通入足量的溴水中,充分反应后,溴水的质量增加了2.1g。试填写下
列空白:
(1)混合气体中含有烷烃的名称是 ,含有烯烃的名称是 。
(2)写出该烷烃的电子式,写出该烯烃的结构简式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com