
21.(6分)
(1)下列操作正确的是 (填字母编号)(错选扣分)
A.将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH
B.制备Fe(OH)2时,将盛NaOH(aq)的滴管伸入到试管内FeSO4(aq)的液面下
C.焰色反应操作是:将铂丝放在稀盐酸中洗涤,然后蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色
D.中和滴定中,锥形瓶用蒸馏水洗净后直接往其中注入一定量的待测溶液或标准溶液
E.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
F.配制0.1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放人容量瓶中加水稀释
G.用盐析法除去淀粉溶液中混有的NaCl杂质
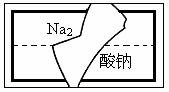 (2)某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验验证。
(2)某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验验证。
①猜想:这种试剂可能是 。
②验证方法: 。
20.下列四个实验结论中,肯定有错误的是
①有一瓶澄清的碱性溶液,做离子鉴定时得出结论是含有Ca2+、Fe2+、Na+、Cl-和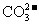
②一固体混合物溶于水后,检验出含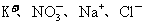 ,则固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物。
,则固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物。
③固体氢氧化钠部分吸收了空气中的二氧化碳并溶于水后,溶液中含有较多的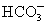
④配制FeCl3溶液时,常将FeCl3固体溶于较浓的盐酸中,然后再用水稀释到所需的浓度
A.①② B.①③ C.②③ D.②④
19.在一定温度下,物质M的溶解度为a g。向(100+a) g物质M的饱和溶液中加入a g M,析出带一定结晶水的晶体b g,现取出b g结晶水合物加水配成相同温度下的饱和溶液,需加水的质量为
A.100g B.大于100g C.小于100g D.(100+a)g
18.将76.8 mg铜与适量的浓硝酸反应,当铜全部溶解后,如果NO3-减少2×10-3 mol,则溶液中H+同时减少
A.4.8×10-3 mol B.4.4×10-3 mol
C.3.2×10-3 mol D.2.2×10-3 mol
17.用惰性电极实现电解,下列说法正确的是
A.电解氢氧化钠溶液,要消耗OH-,故溶液pH减小
B.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
16.下列叙述中,正确的是
①中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1醋酸所需同种碱液的量不同
②体积相同、pH相等的盐酸和硫酸溶液中,H+的物质的量相等
③常温下,pH=3的甲酸溶液中c(H+)与pH=11的氨水中的c(OH-)相等
④锌与pH= 4的盐酸反应比跟pH=3的醋酸溶液反应程度剧烈
A.①③ B.①④ C.② D.②③
15.将1 mol CO和1 mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:CO+H2O(g)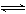 CO2+H2,此时有
CO2+H2,此时有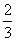 的CO转化为CO2。若在相同条件下,向容器中充入1 mol CO2、1 mol H2和1 mol H2O(g),则达到平衡时,平衡混合物中CO2的体积分数可能是下列各值中的
的CO转化为CO2。若在相同条件下,向容器中充入1 mol CO2、1 mol H2和1 mol H2O(g),则达到平衡时,平衡混合物中CO2的体积分数可能是下列各值中的
A.22.2% B.27.55% C.33.3% D.36.8%
14.某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) Z(g)+W(s);ΔH>0 则下列叙述正确的是
Z(g)+W(s);ΔH>0 则下列叙述正确的是
A.加入少量W,逆反应速率增大
B.升高温度,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡
D.平衡后加入X,上述反应的ΔH增大
13.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
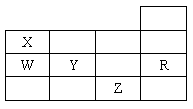 A.常压下五种元素的单质中,Z单质的沸点最高
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
12.NA为阿伏加德罗常数,下列说法正确的是
A.28 g乙烷所含有的电子数目为18NA
B.常温常压下,1 g氢气所含有的原子数目为NA
C.标准状况下,22.4 L单质溴所含有的分子数目为NA
D.电解食盐水若产生71 g氯气,则转移的电子数目为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com