
5.下列各图中,表示正反应是吸热反应的是

4.蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线
柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说
法中正确的是
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C. 充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
3.下列说法一定正确的是
A.其他条件不变时,增大反应物的物质的量,反应速率增大
B.其他条件不变时,升高温度,化学平衡向放热反应的方向移动
C.其他条件不变时,增大压强,化学反应速率增大,化学平衡发生移动
D.其他条件不变时,使用催化剂,化学反应速率改变,化学平衡不移动
2.钢铁发生吸氧腐蚀时,正极反应是
A.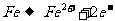 B.
B.
C. D.
D.
1.常温时下列物质的水溶液,pH小于7的是
A. B.
B.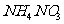 C.
C. D.
D.
26.(11分)
现有等物质的量的NaHCO3和KHCO3的混合物a g与100 mL盐酸反应。(题中涉及的气体体积以标准状况计,填空时可以用带字母的数学公式表示,不必化简。)
(1)该混合物中NaHCO3和KHCO3的质量比为 。
(2)如果反应后盐酸不足量,要计算生成CO2的体积,还需知道 ,
理由是
。
(3)若该混合物与盐酸恰好完全反应,则盐酸中HCl的物质的量浓度为多少?(请写出计算过程)
(4)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时,生成CO2的体积(V)的取值范围是 。
25.(11分)
测定赤铁矿石中铁的的含量,可用如下方法:将一定量的铁矿石经盐酸浸泡后,再加入热的浓盐酸和SnCl2,可得到二价铁,然后用重铬酸钾标准溶液滴定。涉及到的主要反应为:
Ⅰ、Fe2O3+6HCl=2FeCl3+3H2O
Ⅱ、2FeCl4-+SnCl42-+2Cl-=2FeCl42-+SnCl62-
Ⅲ、□Fe2++□Cr2O +□H+-□Fe3++□Cr3++□H2O
+□H+-□Fe3++□Cr3++□H2O
回答下列问题:
(1)SnCl42-中Sn的的化合价为 价。
(2)在一定条件下,铁、锡、铬的高价化合物(或离子)均有较强的氧化性,其氧化性由强到弱的顺序是 。
(3)配平Ⅲ的化学方程式(在方框内填上适当数字)并标明电子转移的方向和数目。
(4)取0.20 g赤铁矿,经处理后(假定处理过程中铁无损失且SnCl42-恰好反应完全),用0.01 mol·L-1的K2Cr2O7标准溶液滴定,达到滴定终点时用去溶液22.30 mL,该赤铁矿中铁的质量分数为 。
24.(8分)
(1)25 ℃时,取0.2 mol·L-1盐酸与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合液中水电离出的c(H+)_________原盐酸中水电离出的c(H+);(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字)
c(Cl-)-c(M+)=__________ mol·L-1
c(H+)-c(MOH)=__________ mol·L-1
(2)25 ℃时,如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则溶液中各离子浓度由大到小的顺序为
23.(12分)
中学化学中几种常见物质的转化关系如下:

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)写出C的酸性溶液与双氧水反应的离子方程式:
。
(4)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
22.(12分)
A、B、C、D为四种短周期元素,A、B、D的原子序数和原子半径均依次增大,这三种元素分别属于不同的周期,B、D同主族。A、B可以形成A2B和A2B2的两种通常情况下呈液态的共价化合物;B、C形成的两种离子化合物溶于水,其所得的溶液均呈强碱性;C的单质常温下可与A2B剧烈反应。试回答下列问题:
(1)元素符号:B___________,C____________;写出B、C两元素形成的四原子核化合物X的电子式为________________________。
(2)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式为_________________________________________________。
(3)为了除去A2DB4稀溶液中混有的A2DB3,常采用A2B2为氧化剂,发生反应的离子方程式为___________________________________________________。
(4)已知A、D两元素组成的化合物在B的单质中完全燃烧的燃烧热为a kJ·mol-1,则燃烧时的热化学方程式为_________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com